
| 品种:短毛猫 | |
| 年龄:4岁 | |
| 性别:雌 | |
| 诊断:骨肉瘤 | |
01 主诉及病史
因呼吸困难、鼻出血、厌食和黑便2个月就诊。
02 检查
体重3.4千克。临床表现为鼻腔分泌物带血丝和呼吸困难。淋巴细胞减少(1344个/μL [1500-7000]),尿液分析和血生化(尿素、肌酐、丙氨酸氨基转移酶、碱性磷酸酶、胆红素、磷、总蛋白)均无异常。
面部和颅骨CT显示鼻腔严重阻塞(下图a),左侧90%和右侧40%受影响(下图b)。胸片未见异常。
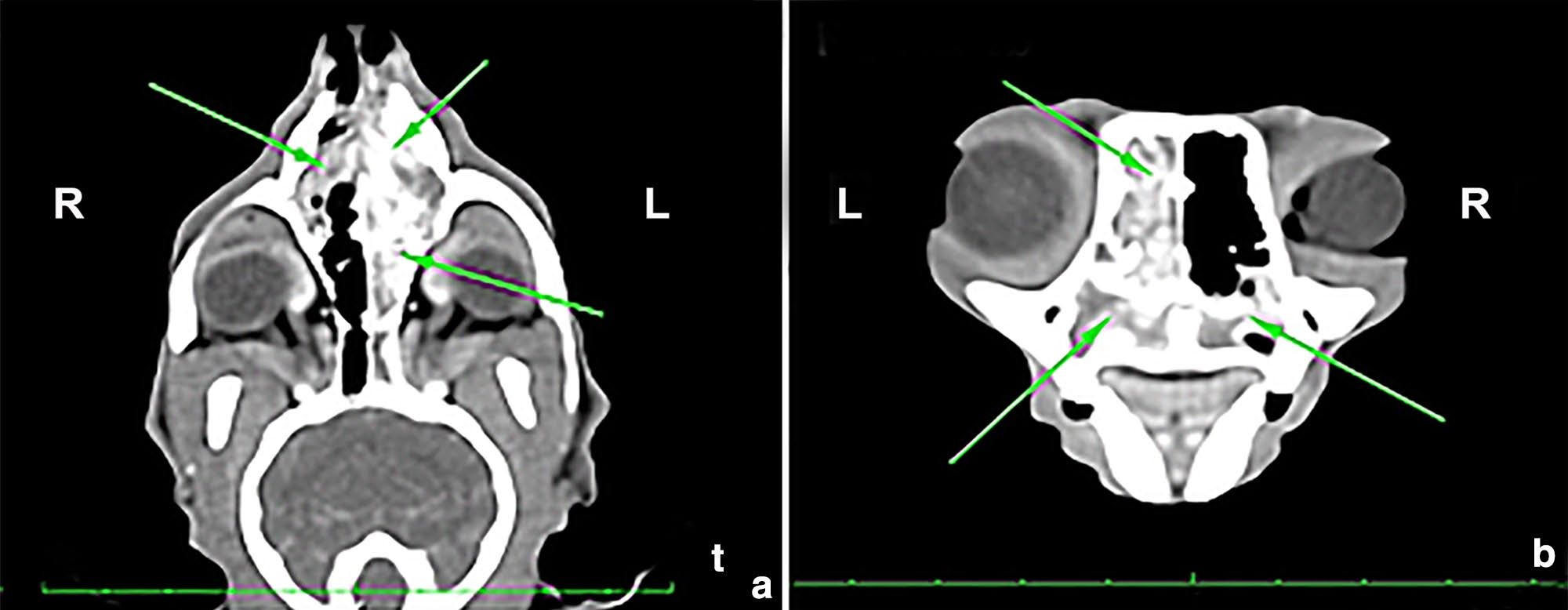
↑ (a) CT背侧平面。鼻腔和乙状窦区域的高摄取区(箭头)与等密度内容物和鼻甲壁增厚有关。(b)CT横断面。双侧鼻腔受累(箭头),左侧鼻腔严重阻塞。
鼻镜检查发现左侧鼻腔内有一个白色新生物(下图)。
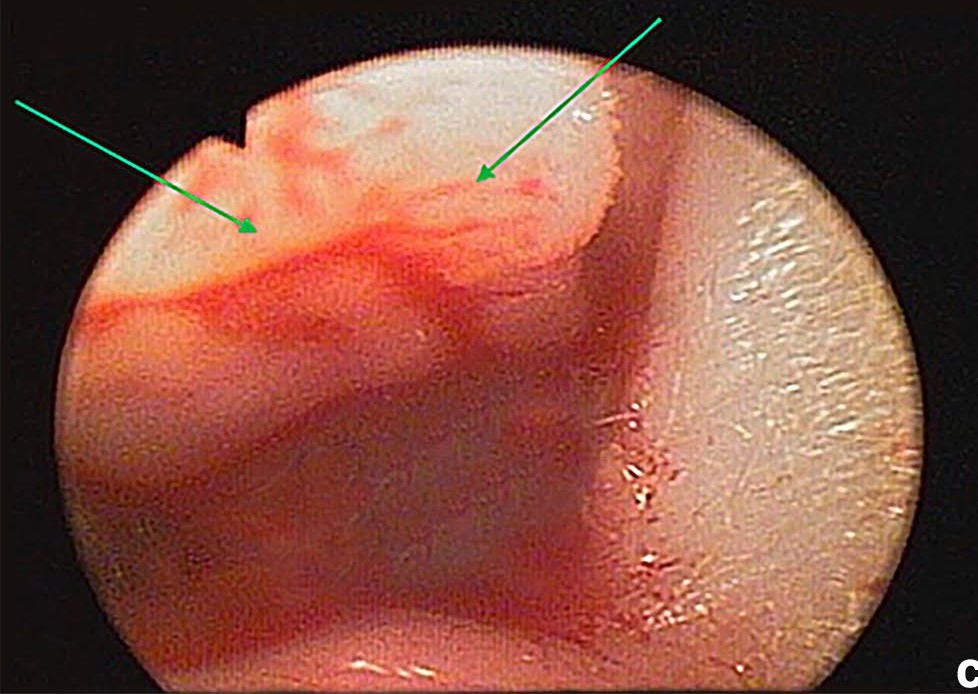
↑ 左侧鼻腔鼻镜检查。白色肿块堵塞气道(箭头)。
对鼻腔肿块进行细针穿刺活检和细胞学检查后发现,肿块内有圆形至纺锤形的非典型细胞,嗜酸性细胞质界限不清,细胞核染色质粗糙,有多个小核泡,符合恶性间叶性肿瘤的特征(下图)。
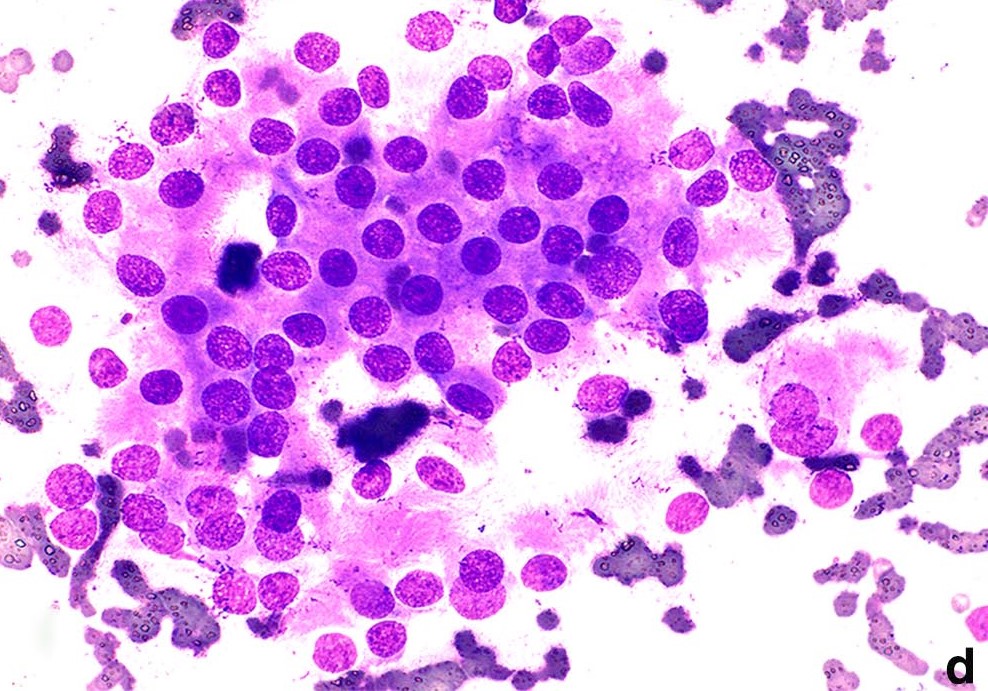
↑ 对鼻腔肿块进行细针活检。一簇圆形至纺锤形的非典型细胞,细胞核染色质粗糙,有多个小核仁,中度异形细胞增多,嗜酸性细胞质界限不清。
活检后左鼻孔大量出血,呼吸困难明显,不得不进行环甲膜切开术以缓解呼吸困难。尽管使用了安乃近(25 mg/kg,q24h)和甲基泼尼松龙(2 mg/kg,IM,每周一次)治疗,但病情继续恶化,呼吸困难加剧,左眼流出血清样分泌物,鼻腔出现溃疡。
03 预后
经过15天的临床治疗,病情继续恶化。随访CT显示肿瘤进展,左上颌骨、上腭和楔形骨板溶骨,侵入颅顶。CT检查后12小时对其实施了安乐死。
04 尸检
在鼻腔平面上发现了一个病灶广泛、环形和弥漫性溃疡,并伴有大量粘液脓性分泌物,骨质溶解与左鼻腔相通(下图a)。鼻腔主要在左侧出现浸润性暗红色肿块,完全取代了鼻甲,并向尾部延伸至喉部。楔形骨板骨质完全溶解,肿瘤浸润大脑额叶(下图b)。
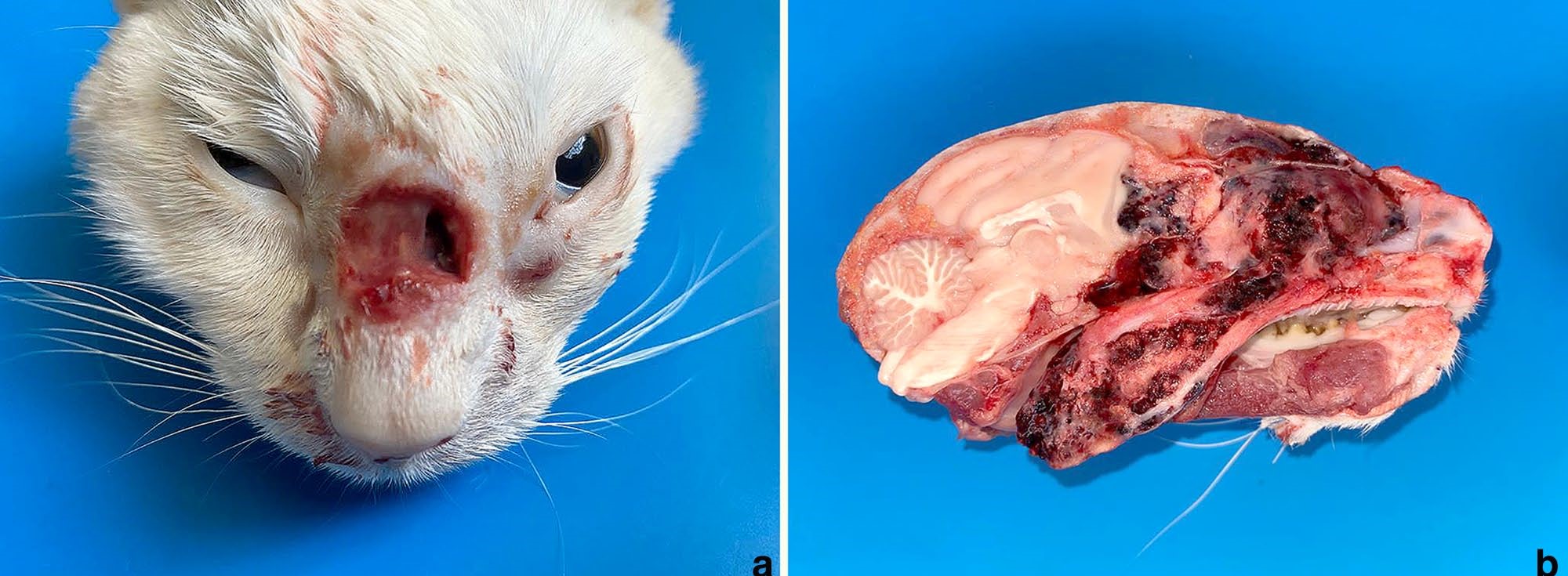
↑ (a)与左鼻腔相通的溃疡性皮肤病变,伴有骨质暴露和溶解。(b)左鼻腔内暗红色肿瘤肿块,取代鼻甲,向喉部扩展,并浸润大脑额叶。
组织学上观察到的是一种无包膜、浸润性和扩张性恶性肿瘤,其特征是骨质和矿化基质的骨小梁以及肉瘤细胞束围绕和衬托着充血的间隙(下图c)。肿瘤细胞浸泡在基质中,显示出圆形中心核,染色质呈细条纹状,嗜碱性细胞质不清晰(成骨细胞),或由一些非典型棘细胞束组成(下图d)。轻度淋巴组织细胞和浆液性炎症浸润渗透到肿瘤增生处。大脑左额叶的大血管床和骨小梁周围出现广泛肿瘤细胞浸润。在其他器官和组织中没有观察到类似结果。
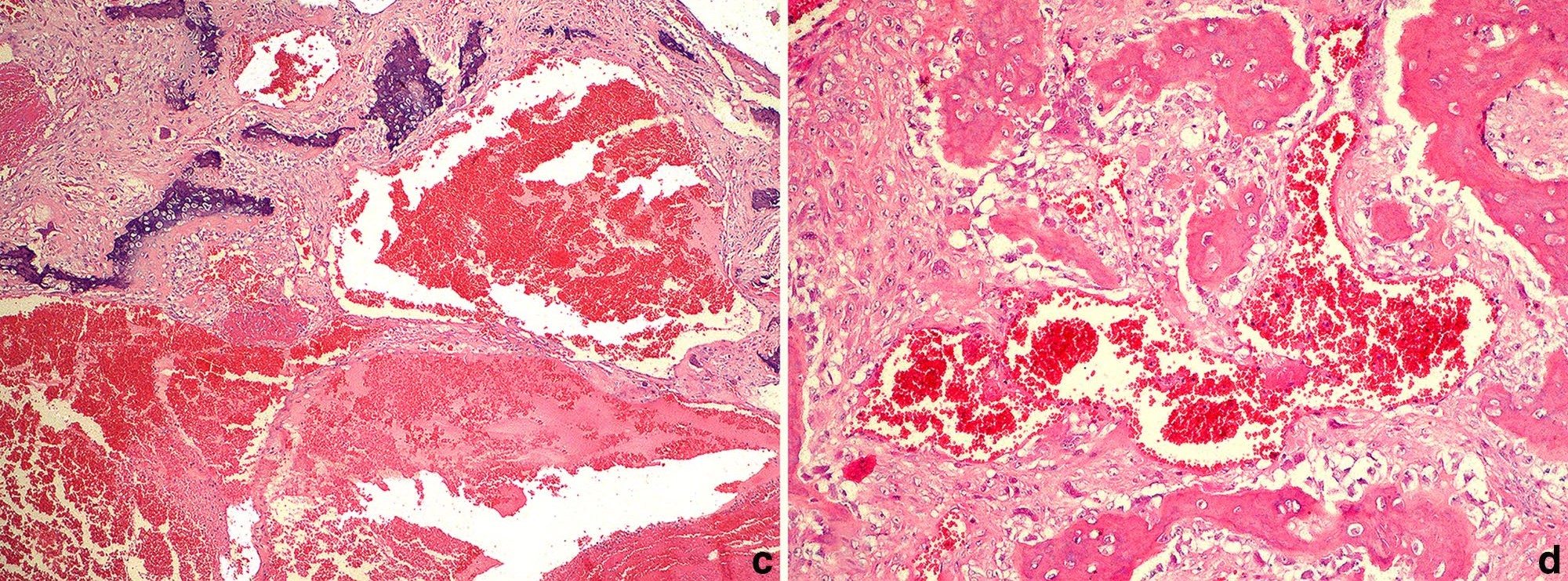
↑ (c)肿瘤性骨增生内充血的非血管间隙。(d)充血的非血管空间周围的骨小梁和肿瘤细胞束。
肿瘤样本还进行了免疫组化。CD31、Von Willebrand因子(VWF)、成骨细胞标记物(OBM)、骨生成素(OSP),波形蛋白(VIM)染色结果显示,肿瘤细胞表现出OBM(下图a)、OSP(下图b)和VIM(下图c)的免疫染色。肿瘤内充血间隙内的细胞对CD31和VWF没有免疫反应(下图d)。
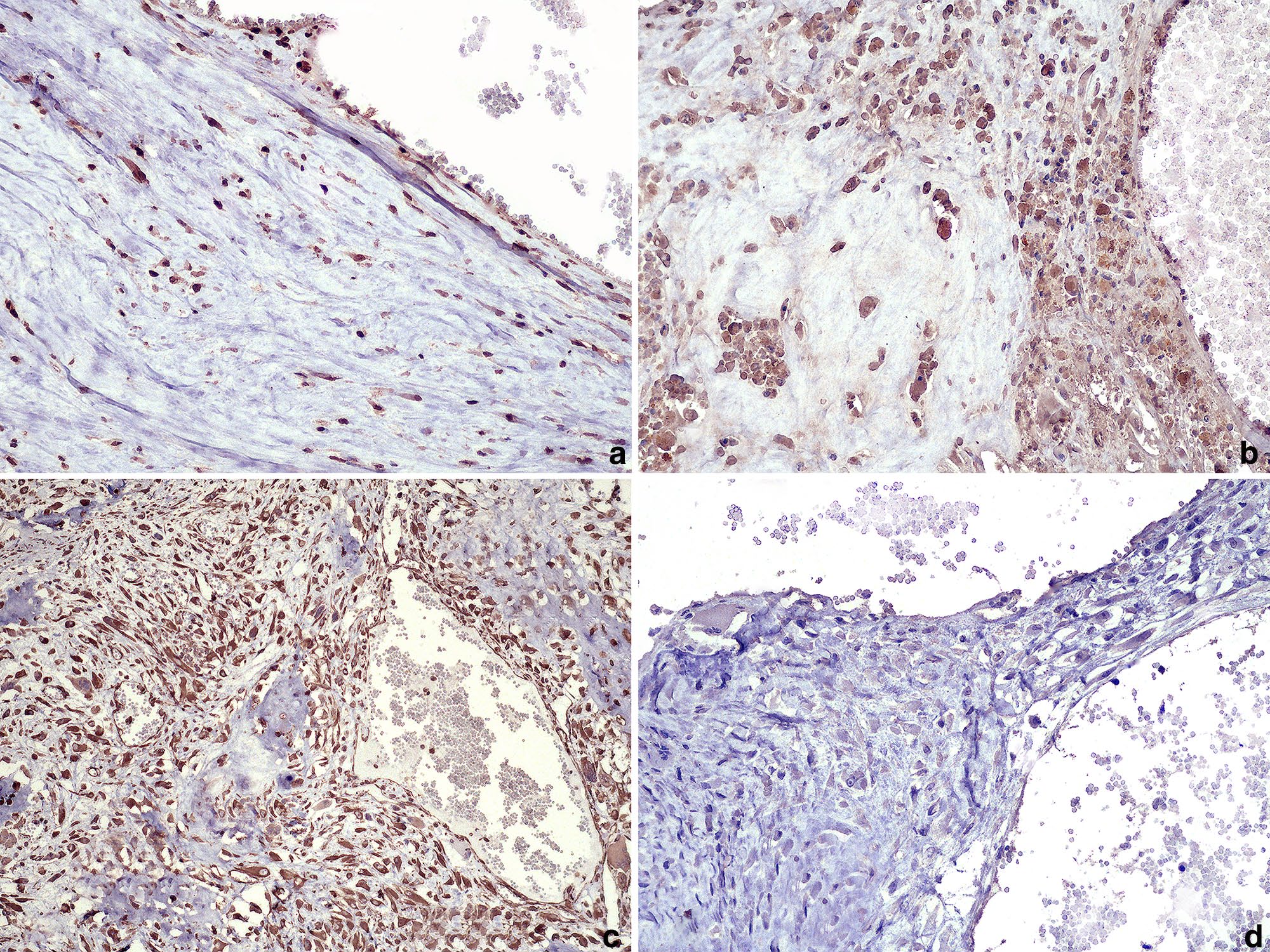
↑ (a)肿瘤内的肿瘤细胞和内衬充血的非血管间隙的免疫染色(成骨细胞标记物)。(b)小梁内的肿瘤细胞强烈表达骨蛋白(OSP)。(c)肿瘤细胞显示明显的间质标记物(VIM)免疫染色。(d)充血的非血管腔内衬细胞缺乏免疫染色。
05 讨论
在猫的诊疗过程中,鼻腔疾病给饲养者和临床医生带来了独特的挑战,因为许多影响鼻腔的常见疾病都表现出类似的临床症状,包括呼吸困难、流鼻涕、打喷嚏和流鼻涕[1]。
上皮肿瘤和淋巴瘤是猫鼻腔最常见的肿瘤[1,2]。相比之下,鼻腔骨肉瘤(Osteosarcomas,OS)在家猫中却极为罕见[3]。OS是家养动物和人类最常见的原发性骨肿瘤[4],占猫原发性骨肿瘤的大多数(70-80%)[5,6],估计发病率为万分之4.9[7]。
由于大规模研究的数量有限[4],目前还没有很好地确定猫OS的首发部位,但有报道称它们发生在轴向骨骼(包括头骨、上颌骨、下颌骨和椎骨)和附属骨骼(如长骨和跗关节)[5,6]。组织病理学上,OS可分为成骨细胞型、分化不良型、软骨细胞型、成纤维细胞型、毛细血管扩张型和巨细胞型。
毛细血管扩张型骨肉瘤(Telangiectatic osteosarcoma,TOS)是OS中最罕见的亚型,其特征是在侵袭性骨质增生和溶骨病变中出现大的充血性空洞[4,8]。TOS在兽医文献中并不常见,此前仅有2例猫TOS的病例报道[9,10]。
本研究中的这只猫比之前报道的一例TOS病例[9]中的猫年龄大,但比1例未分化OS病例[3]中的猫年龄小,这表明年龄尚未被确定为TOS的易感因素。在这只猫身上观察到的临床症状,包括面部肿胀、不对称和鼻腔阻塞,与其他TOS病例中报告的症状一致[3,9,10]。一般来说,临床症状主要归因于鼻腔阻塞,尽管该病例中存在脑肿瘤侵犯,但猫并未表现出任何神经症状。
从外观上看,TOS可能与血管肉瘤相似,因为它有多发性出血形成。这种相似性可能是本病例在活检过程中观察到大量出血和左鼻腔狭窄的原因。不过,TOS和血管肉瘤的显微镜下鉴别方法是在恶性多形性间充质细胞内衬的大小不一的血管间隙中穿插骨样基质[4]。
内衬充血空隙的肿瘤细胞对VWF[16]和内皮标记物CD31的免疫染色呈阴性,这对区分TOS和血管肉瘤至关重要,也支持了该猫的诊断。除了OS的典型组织学特征外,肿瘤细胞与OBM[17]、OSP[18]和VIM的免疫标记也证实了鼻腔肿瘤的骨源性。这些发现对于诊断高血管化OS也很重要,因为高血管化OS是由内皮细胞免疫染色VWF的血管空间区分的,而这只猫没有观察到这种情况。
虽然之前记录的2例猫TOS均未发现转移[9,10],但本病例中的肿瘤明显直接延伸至中枢神经系统。这种以直接扩展到神经系统为特征的肿瘤入侵形式更常见于垂体和鼻腔肿瘤[19]。相反,OS通常通过血源性途径扩散到肺部[4,20]。
虽然猫OS的生物学行为(转移率相对较低)与在狗身上观察到的不同[11],但TOS与狗和人类的不良预后有关[4]。对于猫,由于有关影响鼻腔和头部的TOS的资料有限,因此还需要进一步研究。在本病例中,鉴于预后不良,为避免进一步的痛苦,选择了安乐死[10]。
总之,鼻腔、面部或其他头部结构的受累给TOS病例的预后和治疗带来了很大的障碍,因为它通常会损害呼吸和进食等基本功能,导致患者迅速衰弱,预后不佳,最终导致迅速死亡。尽管TOS很罕见,但应将其作为患有鼻腔阻塞性病变的猫的鉴别诊断。此外,这例TOS病例为比较猫和人类的肿瘤提供了宝贵的机会。这将增加我们对这种罕见的侵袭性肿瘤的诊断、预后和潜在治疗策略的了解。
文献来源:Silva AS, de Sousa ALV, Diniz NSNB, de Macêdo IL, da Costa Júnior JD, Martins CS, de Melo CB, de Castro MB. Nasal telangiectatic osteosarcoma with direct extension to the brain in a domestic shorthair cat. JFMS Open Rep. 2024 Dec 16;10(2):20551169241293956.
参考文献
1. Ferguson S, Smith KC, Welsh CE, et al. A retrospective study of more than 400 feline nasal biopsy samples in the UK (2006–2013). J Feline Med Surg 2020; 22: 736–743.
2. Mukaratirwa S, van der Linde-Sipman J, Gruys E. Feline nasal and paranasal sinus tumours: clinicopathological study, histomorphological description and diagnostic immunohistochemistry of 123 cases. J Feline Med Surg 2001; 3: 235–245.
3. Abushhiwa MH, Al-Azreg SA, Tmumen SK, et al. Clinical, radiological and pathological findings of primary nasal osteosarcoma in a Libyan cat. Open Vet J 2020; 9: 331–334.
4. Thompson KG, Dittmer KE. Tumors of bone. In: Meuten DJ. (ed). Tumors of domestic animals. 5th ed. Hoboken, NJ: John Wiley & Sons, 2017, pp 287–338.
5. Liu SK, Dorfman HD, Patnaik AK. Primary and secondary bone tumours in the cat. J Small Anim Pract 1974; 15: 141–156.
6. Quigley PJ, Leedale AH. Tumors involving bone in the domestic cat: a review of fifty-eight cases. Vet Pathol 1983; 20: 670–686.
7. Dorn CR, Taylor DO, Schneider R, et al. Survey of animal neoplasms in Alameda and Contra Costa Counties, California. II. Cancer morbidity in dogs and cats from Alameda County. J Natl Cancer Inst 1968; 40: 307–318.
8. Cagle LA, Maisel M, Conrado FO, et al. Telangiectatic osteosarcoma in four dogs: cytologic, histopathologic, cytochemical, and immunohistochemical findings. Vet Clin Pathol 2024; 53: 85–92.
9. Havlicek M, O’Connell K, Langova V. Feline maxillary telangiectatic osteosarcoma in a two-year-old cat. Aust Vet J 2008; 38: 92–96.
10. Rieckhoff T, Ludwig E. Teleangiektatisches osteosarkom bei einer katze. Kleintierpraxis 2016; 61: 317–324.
11. Dimopoulou M, Kirpensteijn J, Moens H, et al. Histologic prognosticators in feline osteosarcoma: a comparison with phenotypically similar canine osteosarcoma. Vet Surg 2008; 37: 466–471.
12. Mellanby RJ, Herrtage ME, Dobson JM. Long-term outcome of eight cats with non-lymphoproliferative nasal tumours treated by megavoltage radiotherapy. J Feline Med Surg 2002; 4: 77–81.
13. Malinowski C. Canine and feline nasal neoplasia. Clin Tech Small Anim Pract 2006; 21: 89–94.
14. Burkhard MJ. Respiratory tract. In: Raskin RE, Meyer DJ. (eds). Canine and feline cytology: an atlas and interpretation guide. 3rd ed. São Paulo: Roca, 2016, pp 138–190.
15. Sabattini S, Renzi A, Buracco P, et al. Comparative assessment of the accuracy of cytological and histologic biopsies in the diagnosis of canine bone lesions. J Vet Intern Med 2017; 31: 864–871.
16. Giuffrida MA, Kamstock DA, Selmic LE, et al. Primary appendicular hemangiosarcoma and telangiectatic osteosarcoma in 70 dogs: a veterinary society of surgical oncology retrospective study. Vet Surg 2018; 47: 774–783.
17. Rosa JT, Witten PE, Huysseune A. Cells at the edge: the dentin-bone interface in zebrafish teeth. Front Physiol 2021; 12.
18. Kuwabara H, Fujita K, Yuki M, et al. Cytokeratin-positive rib osteosarcoma metastasizing to the small intestine. Indian J Pathol Microbiol 2014; 57: 109–112.
19. Snyder JM, Lipitz L, Skorupski KA, et al. Secondary intracranial neoplasia in the dog: 177 cases (1986–2003). J Vet Intern Med 2008; 22: 172–177.
20. Silva JAM, Marchiori E, Macedo FC, et al. Pulmonary metastasis of osteosarcoma: multiple presentations in a single patient. J Bras Pneumol 2022; 48.