
| 品种:迷你雪纳瑞 | |
| 年龄:12岁 | |
| 性别:雄 | |
| 诊断:腺性膀胱炎 | |
01 主诉及病史
持续出现排尿困难、尿痛和血尿,治疗效果不佳。
曾多次尝试使用阿莫西林、阿莫西林-克拉维酸、恩诺沙星和美洛昔康,但均未进行尿液培养,临床症状在间歇性改善后又复发。3年前接受过双眼白内障手术,2年前被诊断为糖尿病,通过胰岛素和饮食控制,血糖正常。
02 检查
体重9.2千克。精神良好,体况评分6/9,被毛完好,体温38.3°C,水合状态正常,粘膜湿润,毛细血管再充盈时间正常,平均收缩压135 mmHg,脉搏正常,心率112次/分,无明显心血管或肺部症状,触诊膀胱区时有轻微腹痛。
全血细胞计数无异常。除了明显的高胆固醇血症(1134 mg/dL [135-270])外,其余生化结果正常。尿液浓缩能力正常(尿比重大于1.035),无葡萄糖尿、轻度血尿(15-20倍)和白细胞尿(20-25倍)。
超声心动图和心电图未发现变化。腹部超声显示双肾未受影响,胰腺无变化,肠道无明显变化,中度肝肿大。膀胱壁厚度不规则增加(4.8 mm),同时有多个不动的结构,起源于背侧表面,纵向直径不等,凸状高回声界面伴有声影(下图),彩色多普勒难以确定是否有血管形成。
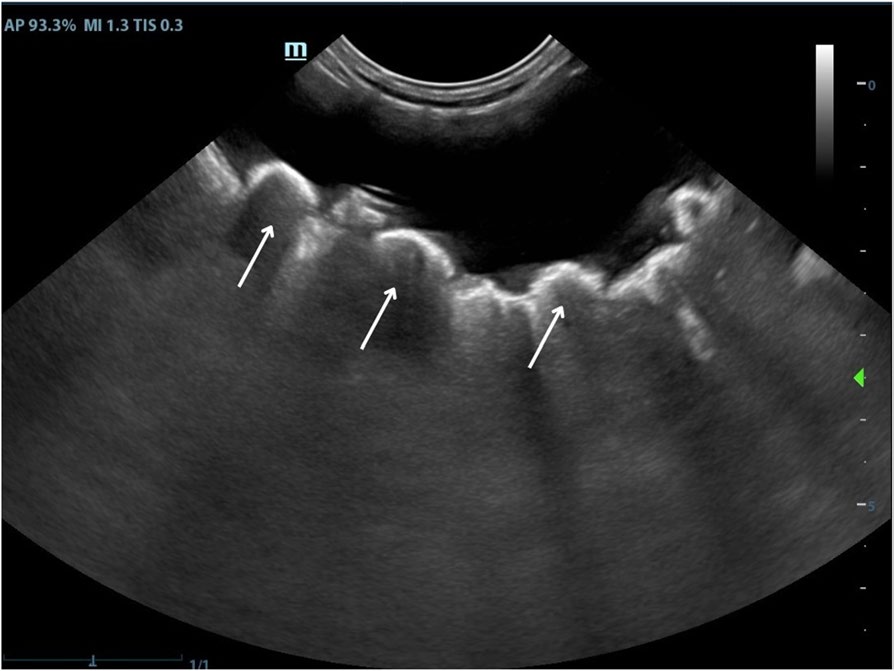
↑ 膀胱纵向超声。可观察到与膀胱壁相关的多发结节,其间有高回声界面和声影(白色箭头)。
根据患者的病史、临床症状、超声结果以及无法进行膀胱镜检查的情况,决定进行膀胱切开探查术,鉴别诊断为多发性膀胱结石、尿路上皮弥漫性钙化、多发性息肉样膀胱炎和膀胱肿瘤。
03 手术
在使用芬太尼(5 μg/kg,IV)和咪达唑仑(0.3 mg/kg,IV)进行预处理、使用丙泊酚(2 mg/kg,IV)进行诱导和使用异氟醚进行维持后,置于背卧位。
通过腹正中切口进行开腹手术,直接观察膀胱。膀胱外部显示为弥漫性出血型深色。在膀胱正中进行切开,以观察尿路上皮。尿路黏膜表面呈深色出血性染色和多个结节状结构(下图),触诊相对困难,主要位于背侧区域,部分位于腹侧区域。
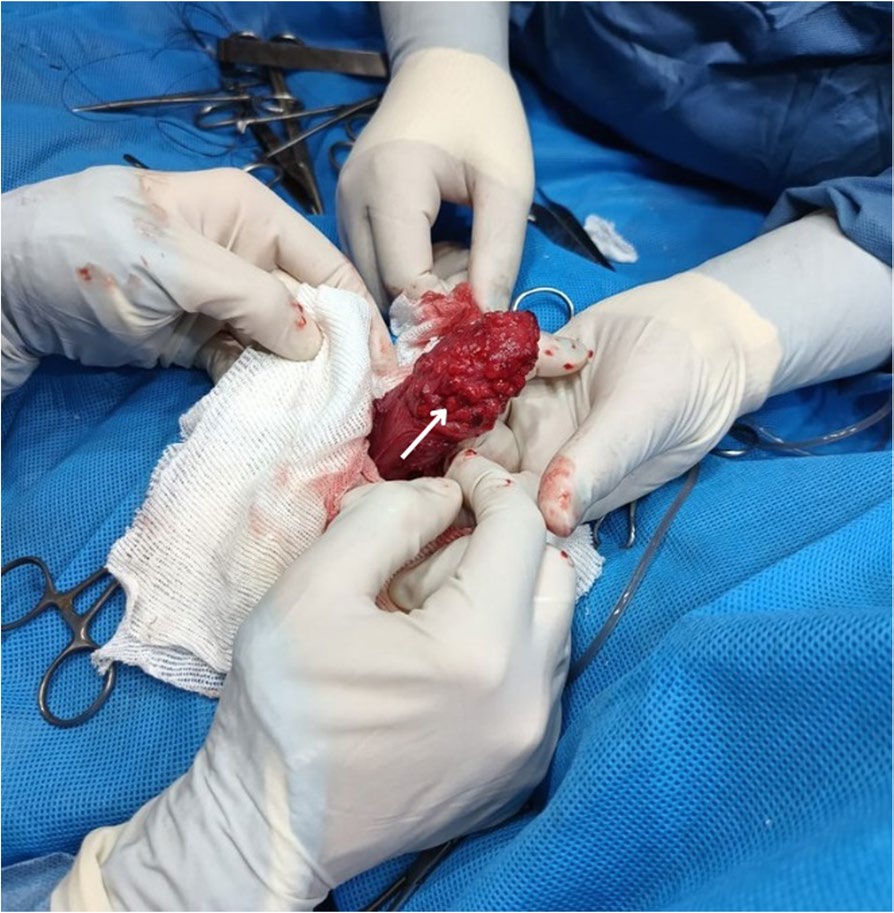
↑ 膀胱切开术暴露的膀胱外部区域和尿路上皮的术中全貌。在背侧区域和部分腹侧区域(白色箭头)观察到多个出血性硬结节病变。
考虑到这种弥漫性病变很难成功切除,因此决定尽可能多地切除这些结构。从膀胱壁上采集了一些样本进行组织病理学检查和细菌培养。还用无菌注射器从膀胱中抽取了10 mL尿液进行细菌培养。在采集尿样之前,患者已21天未接受抗生素治疗。
组织学检查显示,膀胱壁有增生的尿路上皮,由5-6层细胞组成,有局灶性内陷,腺体结构在粘膜绒毛上呈管状,内衬单层同形立方细胞,卵圆形中心核,有颗粒状染色质和嗜酸性细胞质(下图)。

↑ 膀胱切开取样的膀胱壁显微照片。可见腺体结构(黑色箭头)和单层的立方体细胞,以及一般的同形结构。
对尿道上皮和尿液进行细菌培养后发现了大肠埃希菌,对几乎所有抗生素都敏感。根据上述结果,诊断为腺性膀胱炎。开始使用阿莫西林-克拉维酸(13.75 mg/kg,PO,q12h)和美洛昔康(0.1 mg/kg,PO,q24h)进行治疗。
04 预后
术后1周,没有出现任何全身临床症状或尿路症状。于是停用美洛昔康,只用阿莫西林-克拉维酸。
术后4周,病情持续好转,无相关临床症状,膀胱超声显示膀胱壁明显改善,腺体结构完全缓解(下图)。超声引导下进行膀胱穿刺,获取无菌尿液样本进行细菌培养,结果为阴性,于是停止了抗生素治疗。
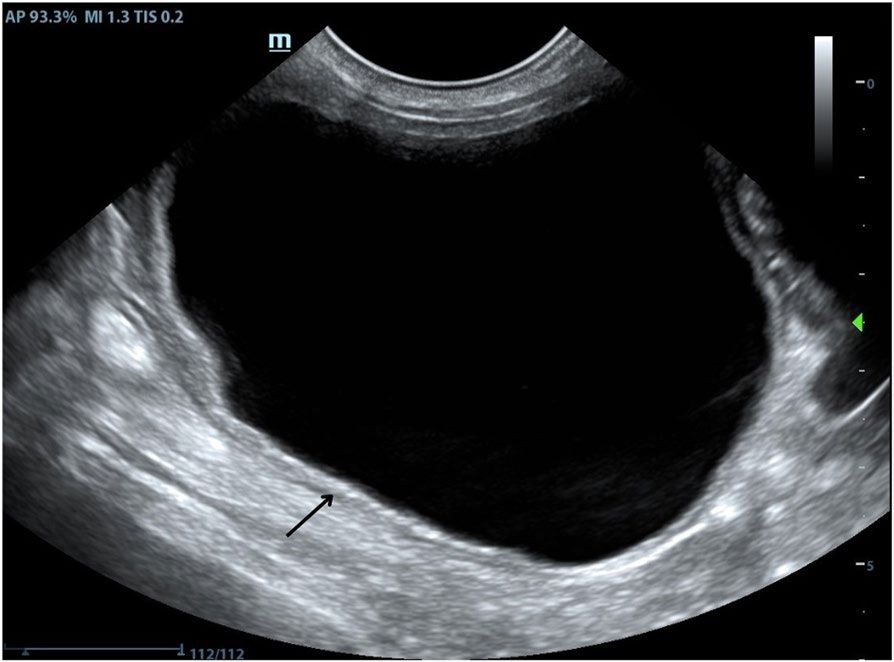
↑ 治疗4周后膀胱的纵向超声检查。膀胱壁的分层和清晰度得到了保留(黑色箭头),腔内有无菌性内容物,没有高回声界面结构。
迄今为止,患者没有再出现任何可归因于这种病理变化的临床症状。
05 讨论
狗的下尿路疾病是一种常见的临床症状,包括尿路感染(urinary tract infection,UTI)、排尿障碍、尿路结石、前列腺病变、外伤和肿瘤[1]。在这组病症中,犬UTI的发病率为39.3%[2]。泌尿道神经系统疾病、解剖异常、留置导尿管或间歇性导尿管、肾上腺皮质功能亢进和糖尿病是导致UTI发病率较高的危险因素[3]。
UTI与临床症状之间没有直接联系,因此很大一部分狗是没有症状的[3]。由于UTI的临床症状没有特异性,因此细菌培养是确定是否存在菌尿的首要条件,从而正确确定抗菌治疗方法[2]。
在人类糖尿病患者中,UTI是最常见的长期并发症之一,发病率高达39.3%[4]。在患有糖尿病的狗中,尿液细菌培养阳性率从14%到24%不等[5,6]。腺性膀胱炎是膀胱的一种炎症,其特点是尿路上皮细胞增生,通常是对刺激物的反应[7]。本报告描述了一只患有膀胱炎的迷你雪纳瑞犬的UTI症状。
与糖尿病和尿毒症密切相关的病理生理机制现已得到充分了解,尤其是与大肠杆菌感染有关的机制。高浓度葡萄糖会降低血清和尿液中的抗菌肽水平,损害上皮屏障功能,同时改变细胞膜蛋白和细胞骨架元素,导致细菌负荷增加、先天性免疫反应受损和上皮完整性受损[10]。
腺性膀胱炎是一种发生在膀胱的异常炎症,其特点是尿路上皮因慢性炎症而发生增生。其表现形式在人类医学中最为常见,主要影响男性。其病理生理学至今仍不甚明了,但其中一种理论认为,移行上皮在受到碎石、长期尿淤积、泌尿系统感染或肿瘤等刺激因素的影响时,可能会发生变态反应[11]。
尿路上皮细胞的增生导致组织学上出现von Brunn’s巢,这是一种具有管腔和分泌细胞的尿路上皮细胞,使其具有腺样外观[11]。此外,由移行上皮组成的管状和针状结构可深入粘膜下层[7]。尿路上皮的宏观特征无法区分慢性炎症和肿瘤浸润,因此活检是确诊的首要条件[12]。迄今为止,兽医学中关于这种临床表现的报道很少,只有2篇关于猫的报道[12,13],1篇关于一只雌性雪纳瑞的报道[14]。在其中一篇报道中,膀胱异物(导尿管)被定义为可能的致病原因[12],但在另外两篇报道中,对于病变的可能来源没有得出结论[13,14]。
治疗方法包括治疗泌尿系统感染、去除刺激尿路上皮的成分、通过膀胱镜或探查术对肿块进行彻底切除,并进行疼痛治疗[7,12]。在本病例中,由于抗生素治疗效果令人满意,可以推测大肠杆菌感染是腺性膀胱炎发病的诱因。
在人类医学中,腺性膀胱炎可能没有症状,偶尔会出现排尿困难和尿痛,但血尿被描述为这种疾病的代表性临床症状[7]。这些特征与本病例中观察到的不谋而合。
总之,在人类医学史上,有人认为腺性膀胱炎可能是膀胱肿瘤的前期阶段,但目前没有证据表明未来会有恶性肿瘤的风险[15]。这是首例与大肠杆菌UTI相关的腺性膀胱炎病例。应强调细菌学和组织病理学研究在泌尿道病变诊断中的重要性。
文献来源:Amunategui JPR, Echeverria D, Duchene A. Cystitis glandularis due to Escherichia coli infection in a diabetic Miniature Schnauzer: a case report. BMC Vet Res. 2025 Jan 17;21(1):25.
参考文献
1.Mendóza-López CI, Del-Angel-Caraza J, Quijano-Hernández IA, Barbosa-Mireles MA. Analysis of lower urinary tract disease of dogs. Pesq Vet Bras. 2017;37(11):1275–80.
2.Hernando E, Vila A, D’Ippolito P, Rico AJ, Rodon J, Roura X. Prevalence and characterization of urinary tract infection in owned dogs and cats from Spain. Top Companion Anim Med. 2021;43:100512.
3.Thompson MF, Litster AL, Platell JL, Trott DJ. Canine bacterial urinary tract infections: new developments in old pathogens. Vet J. 2011;190(1):22–7.
4.Ahmed AE, Abdelkarim S, Zenida M, Baiti MAH, Alhazmi AAY, Alfaifi BAH, Majrabi RQM, Khormi NQM, Hakami AAA, Alqaari RAM, Alhasani RA, Alajam RA, Alshehri MM, Alenazi AM, Alqahtani B, Alshamrani M, Alhowimel A, Abdelwahab SI. Prevalence and associated risk factors of urinary tract infection among diabetic patients: a cross-sectional study. Healthcare (Basel). 2023;11(6):861.
5.McGuire NC, Schulman R, Ridgway MD, Bollero G. Detection of occult urinary tract infections in dogs with diabetes mellitus. J Am Anim Hosp Assoc. 2002;38(6):541–4.
6.Nelson V, Downey A, Summers S, Shropshire S. Prevalence of signs of lower urinary tract disease and positive urine culture in dogs with diabetes mellitus: a retrospective study. J Vet Intern Med. 2023;37(2):550–5.
7.Bougrine I, Imrani K, Naggar A, Retal H, Billah NM, Nassar I. Cystitis glandularis mimicking a bladder tumor: a rare case report. Radiol Case Rep. 2024;19(6):2357–61.
8.Niessen SJM, Bjornvad C, Church DB, Davison L, Esteban-Saltiveri D, Fleeman LM, Forcada Y, Fracassi F, Gilor C, Hanson J, Herrtage M, Lathan P, Leal RO, Loste A, Reusch C, Schermerhorn T, Stengel C, Thoresen S, Thuroczy J, ESVE/SCE membership. Agreeing language in veterinary endocrinology (ALIVE): diabetes mellitus – a modified delphi-method-based system to create consensus disease definitions. Vet J. 2022;289:105910.
9.Costa-Santos K, Damasceno K, Portela RD, Santos FL, Araújo GC, Martins-Filho EF, Silva LP, Barral TD, Santos SA, Estrela-Lima A. Lipid and metabolic profiles in female dogs with mammary carcinoma receiving dietary fish oil supplementation. BMC Vet Res. 2019;15(1):401.
10.Mohanty S, Kamolvit W, Scheffschick A, Björklund A, Tovi J, Espinosa A, Brismar K, Nyström T, Schröder JM, Östenson CG, Aspenström P, Brauner H, Brauner A. Diabetes downregulates the antimicrobial peptide psoriasin and increases E. coli burden in the urinary bladder. Nat Commun. 2022;13(1):4983.
11.Borda A, Decaussin Petrucci M, Berger N. Lésions bénignes diverses de la vessie et de la voie excréto urinaire. Ann Pathol. 2004;24(1):6–16.
12.Agut A, Carrillo JD, Soler M, García JD, Belda E, Gómez MA, Bernabe A. Cystitis glandularis in a cat. J Feline Med Surg. 2014;16(4):363–5.
13.Zachary JF. Cystitis cystica, cystitis glandularis, and brunn’s nests in a feline urinary bladder. Vet Pathol. 1981;18(1):113–6.
14.Gelberg HB. Urinary bladder mass in a dog. Vet Pathol. 2010;47(1):181–4.
15.Yi X, Lu H, Wu Y, Shen Y, Meng Q, Cheng J, Tang Y, Wu F, Ou R, Jiang S, Bai X, Xie K. Cystitis glandularis: a controversial premalignant lesion. Oncol Lett. 2014;8(4):1662–4.