
| 品种:短毛猫 | |
| 年龄:3岁 | |
| 性别:雄 | |
| 诊断:真菌性脓胸 | |
01 主诉及病史
两三个星期前,主人发现猫的日常行为发生了变化(活动减少、食欲不振)。
饲养在户外院子里,捕食鸟类(麻雀)非常娴熟,过去曾多次因咬伤和抓伤接受治疗。7天前因轻微呼吸困难和咳嗽被送到一家诊所,被诊断为卡他性肺炎。开了12.5 mg/kg阿莫西林-克拉维酸,但用药后呼吸困难仍持续存在,并且在转诊前几个小时前有所加重。
02 检查
体重3.2千克。有吸气性呼吸困难、浅粉色粘膜、毛细血管再充盈时间为3秒、直肠温度38.6°C、嗜睡和厌食。肺部听诊发现双侧心音低沉(左侧几乎听不到),支气管呼吸音加快,呼吸急促(67次/分),心动过速(188次/分)。没有发现皮肤伤口,但有以前受伤留下的疤痕。
X光片显示双侧胸腔积液,右侧切面上的心脏、纵隔、肺叶被积液遮挡。左侧切面可见肺叶向远离胸背壁的方向回缩,叶间裂不透光,肺边缘变圆,中度肺不张。在背腹切面上,气管向右侧移位,左侧肺叶被渗出液遮挡(下图)。
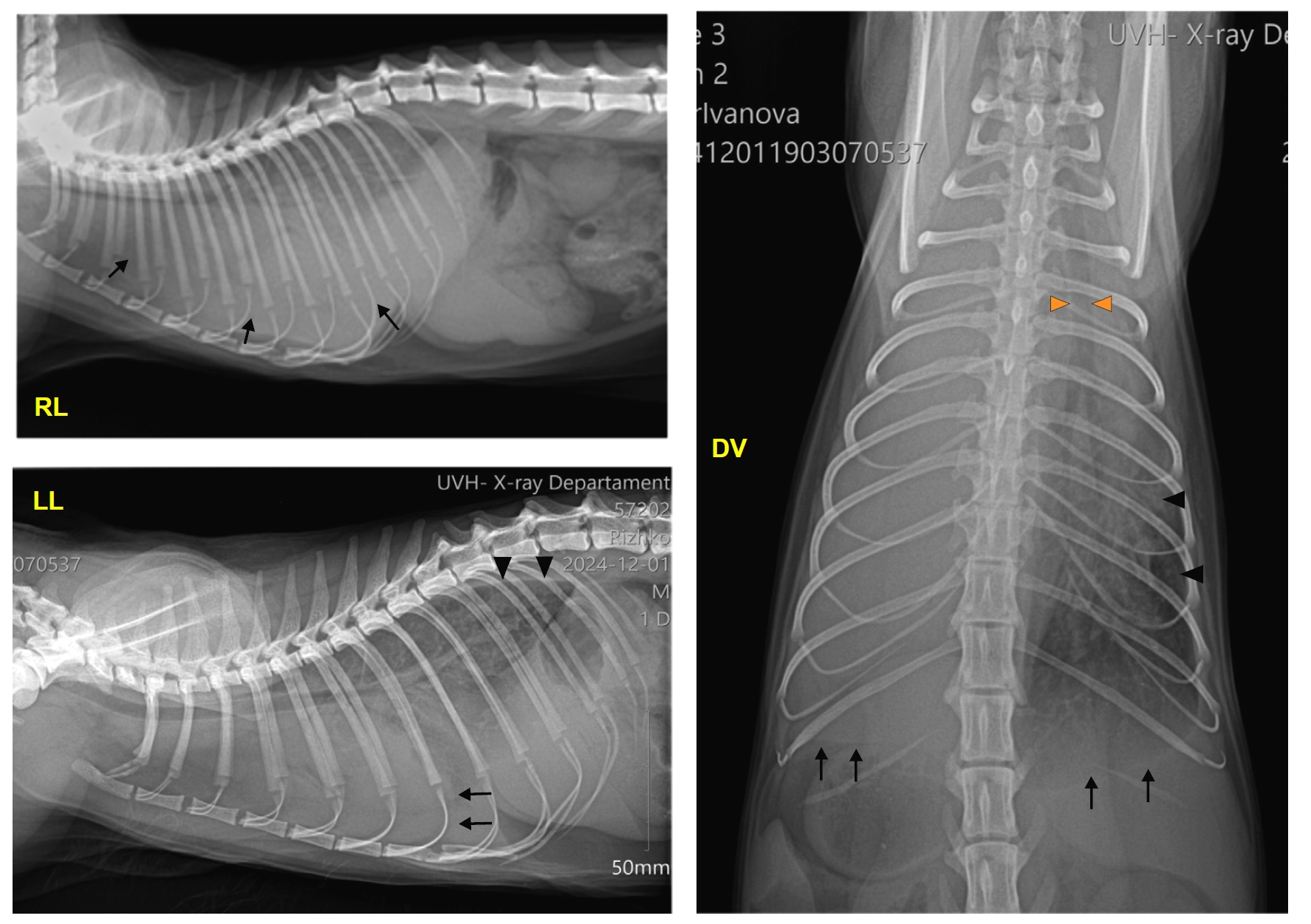
↑ 右侧位(RL)、左侧位(LL)和背腹位(DV)X光片,显示积液(RL黑色箭头)、肺叶回缩(LL、DV黑色箭头)、叶间裂(三角)和气管移位(橙色三角)。
照完相后进行麻醉,使用外周静脉导管和三通止血钳进行了双侧胸腔穿刺(下图)。右侧胸腔穿刺是在第6-7肋间进行的,但只取出了少量液体。在左侧第8肋间抽出了210毫升不透明的乳白色带血胸腔积液。胸腔积液无味、粘稠,含有絮状物。
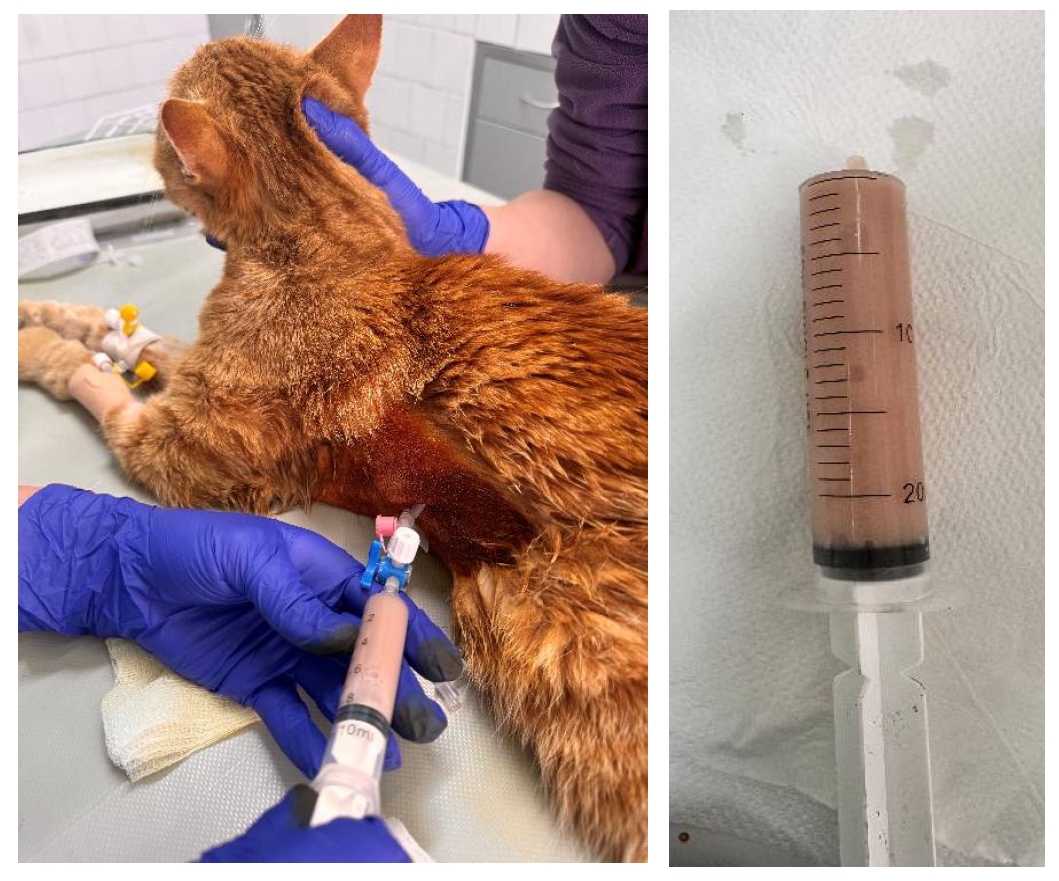
↑ 从左侧第8肋间隙排出的胸腔积液(左图)和积液的外观(右图)。
胸腔穿刺术后,再次进行了侧位X光检查,发现胸腔内仍有一些积液,但器官的可视性明显改善。心脏轮廓已经清晰可见,肺部边界也更加分明。
猫白血病病毒和猫免疫缺陷病毒的快速血液检测结果均为阴性。全血细胞计数和生化显示白细胞增多(46.47 G/L [5.5-19.5])、中性粒细胞增多(41 G/L [2.5-12.9])、肌酸激酶活性升高(2554 U/L [70-160])、血清总蛋白升高(84.4 g/L [57-80])、球蛋白升高(52 g/L [28-45])。
胸腔积液涂片用于细胞学检查,结果显示淋巴细胞直径为5-10 μm,其中大部分细胞的核不规,这可能是由于它们长期滞留在胸腔的渗出物中。还可见中性粒细胞和巨噬细胞(下图)。
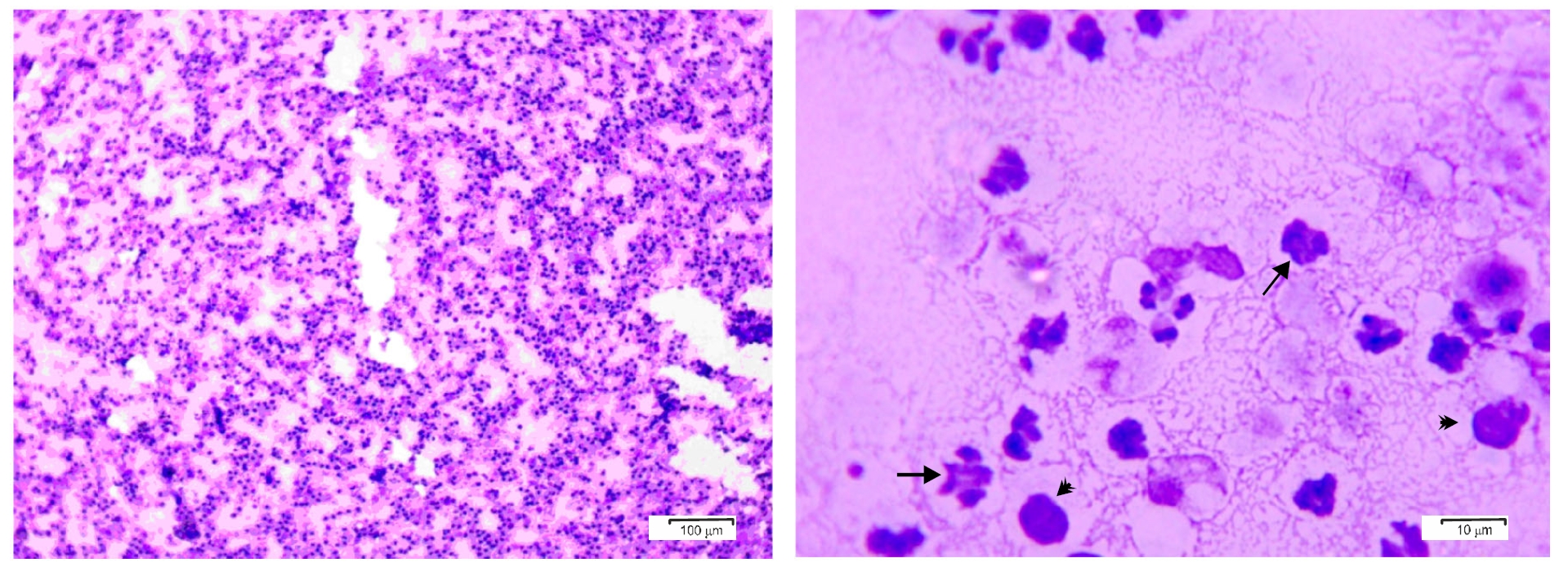
↑ 胸腔积液细胞学涂片显示淋巴细胞、退化的中性粒细胞(箭头)和巨噬细胞(三角)。
使用林可霉素(5.5 mg/kg,q12h,7天)替换了阿莫西林/克拉维酸。
对积液样本进行微生物检查,第48小时,血琼脂平板上出现了几乎无法察觉的白色非溶血性小菌落,沙保琼脂上也出现了白色小菌落。第72小时,血琼脂和沙保琼脂平板上出现了许多圆形、光滑、白色的非融合菌落(下图)。
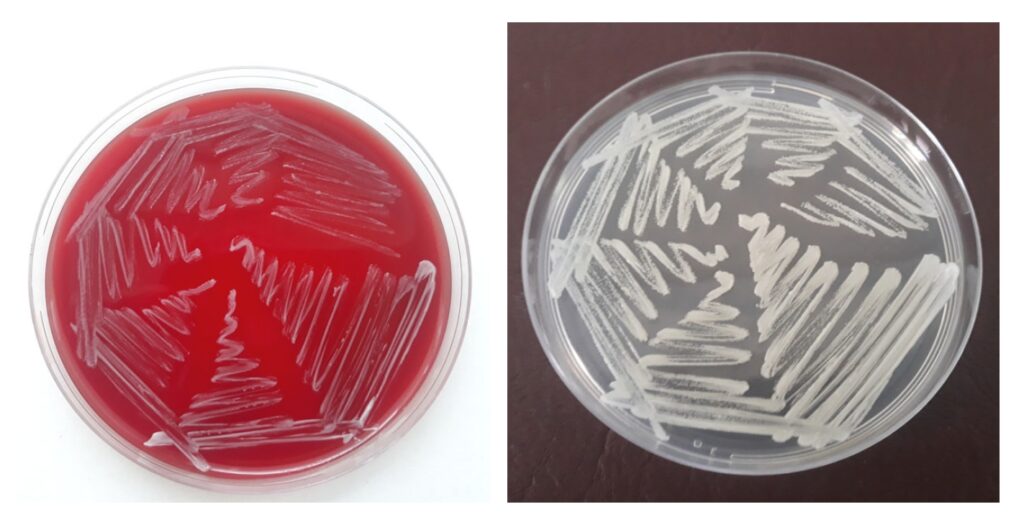
↑ 病原体在37°C的血琼脂(左图)和37°C的沙保琼脂(右图)上培养48小时后的生长情况。
对单独的菌落进行革兰氏染色,可以看到大的圆形革兰氏阳性酵母细胞(下图)。该分离物最终被鉴定为葡萄牙棒孢酵母(Clavispora lusitaniae)。
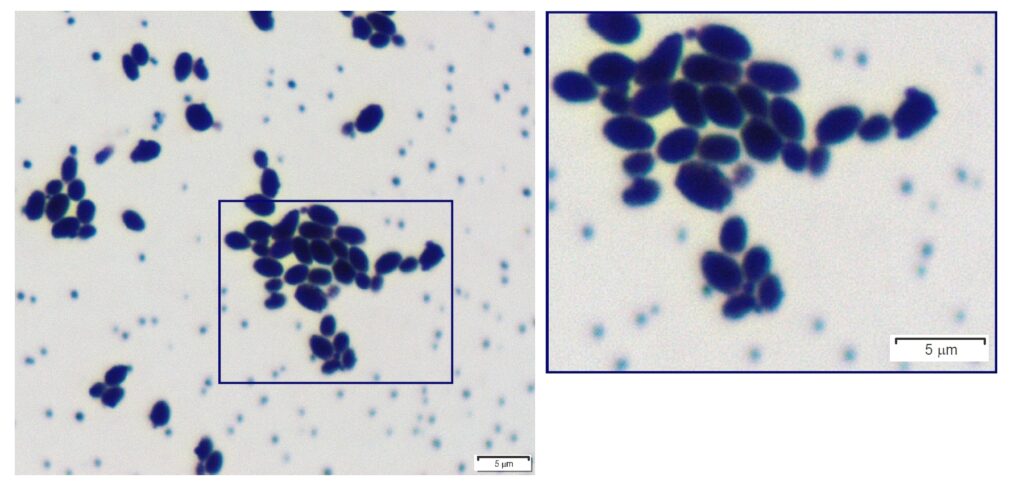
↑(左图)在血琼脂上培养24小时的单个菌落的革兰氏染色涂片;(右图)矩形区域的放大图显示出芽的革兰氏阳性酵母细胞。
第一次胸腔穿刺术后3天,再次因呼吸急促(56次/分)和心动过速(187次/分)入院,直肠温度和毛细血管再充盈时间正常。影像学检查证实了积液的存在,使用相同的麻醉方案在左侧第8肋间隙进行了第二次胸腔穿刺。抽出的胸腔积液为160毫升,白色,不透明,粘稠。白细胞增多(31.9 G/L [5.5-19.5]),中性粒细胞增多(23.7 G/L [2.5-12.9])。医生警告主人可能会反复出现胸腔积液。
03 治疗
根据微生物学检查结果,存在真菌感染。使用了40 mg/kg特比萘芬,连续治疗15天。在抗真菌治疗的同时,还使用了呋塞米(皮下注射2.5 mg/kg)、克林霉素(5.5 mg/kg,q12h)、乳酸林格氏液(每小时注射10 mL/kg)。
第二次胸腔穿刺术后3天,进行了第三次左侧胸腔穿刺,排出了190毫升乳白色液体。术后临床状况有所改善。
04 预后
15天的特比萘芬疗程结束后,主人说该猫已经恢复了活力和食欲。总体状况良好,呼吸和心率正常。白细胞总数(8.21 G/L [2.5-12.9])和中性粒细胞计数(3.06 G/L [2.5-12.9])正常,嗜酸性粒细胞计数略有增加(0.95 G/L [0-0.8])。血清肌酸激酶轻度升高(255 U/L [70-160])。血球蛋白浓度(43 g/L [28-45])正常。
在X线侧位片上(下图),心脏轮廓已经清晰可见。在肺尾部观察到局限性致密灶状均匀阴影(肺不张)。背腹侧切面显示肋膜角区域有均匀的放射影,肺叶回缩(左侧)。气管没有移位,心脏清晰可见,存在中度肺不张。
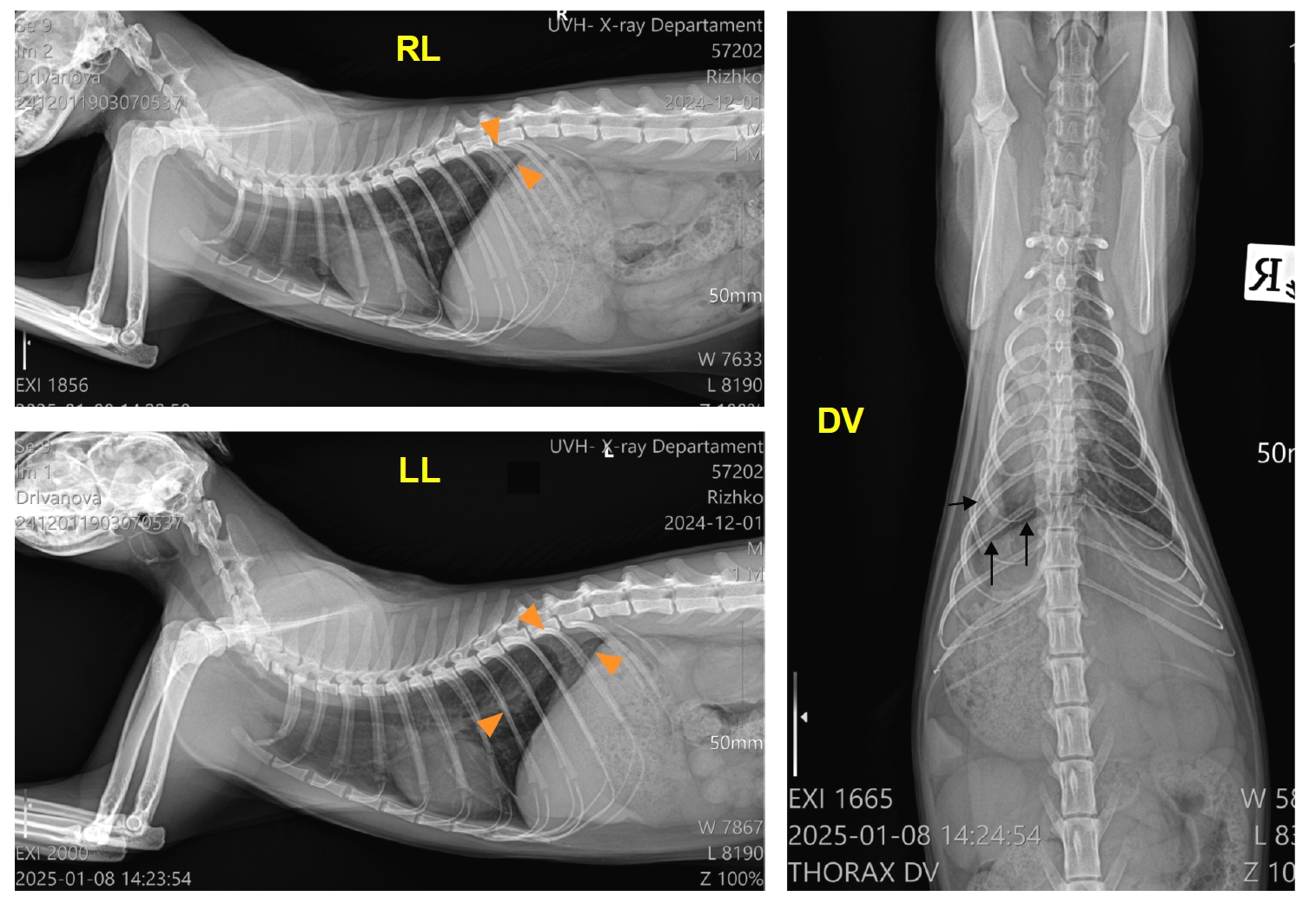
↑ 抗真菌治疗15天后的右外侧(RL)、左外侧(LL)和背腹侧(DV)X光片:中度肺不张区域(RL和LL上的三角);肋骨角区域的均匀放射影(黑色箭头;DV)。
05 讨论
胸腔积液的特点是胸膜腔内有脓性液体积聚。在猫中,这种疾病的病因通常不明确。可能的感染源包括邻近结构的传播(支气管肺炎、气管旁传播、食道破裂)、直接接种(异物移位、穿透性损伤、胸腔手术)或血液/淋巴播散(败血症)[1]。
在大多数情况下,猫脓胸的病因与强制性厌氧菌(梭状芽孢杆菌、镰刀菌、巴氏杆菌)和/或兼性需氧菌的合并感染有关。有大肠埃希菌、沙门氏菌、克雷伯氏菌、假单胞菌等参与的病例发病率低于20%[2]。猫脓胸的真菌病原体很少见报道,包括隐球菌、白色念珠菌、皮炎播散酵母菌[3,4]和球孢子菌[5]。
最近一篇关于猫侵袭性真菌感染的综述指出,猫的侵袭性念珠菌病非常罕见,已发表的病例不到10例,这与下尿路的非侵袭性念珠菌病不同,后者更为常见[6]。侵袭性念珠菌病可能发生在任何年龄段的任何性别的猫身上。尽管病史中通常会有并发症,但它们常常被诊断为表面上免疫功能正常的猫。
近些年来,从侵袭性真菌感染,尤其是肺水肿中分离出的非白色念珠菌病原体越来越多[7,8]。其中,葡萄牙棒孢酵母(Clavispora lusitaniae)是一种新出现的感染免疫抑制患者、持续接受抗生素治疗和癌症化疗者的院内病原体[9],但也有报道称它是急性呼吸窘迫的免疫功能正常患者胸腔积液的病原体[10]。
在一例腹膜炎病例中,首次报告了猫对葡萄牙棒孢酵母的侵袭性感染[11]。该分离株对测试的抗真菌药物(包括两性霉素B)敏感,这是因为在抗真菌治疗前缺乏选择性压力和病原体分离。
最初将患者转诊后,医生根据经验处方了广谱林可霉素类药物克林霉素,以控制猫脓胸最常见的病原体——厌氧菌和革兰氏阳性需氧菌(包括大多数葡萄球菌和链球菌)[12]。
由于只有少数抗真菌药物获准用于兽类,因此选择特比萘芬主要是基于其活性谱和方便的片剂大小。特比萘芬对猫的口服剂量为30-40 mg/kg,每天一次[13]。特比萘芬对许多真菌都有用,包括酵母菌和皮癣菌。除杀真菌活性外,特比萘芬还具有消炎作用[14]。
由于真菌生长速度慢,且具有杀真菌的作用机制,因此抗真菌治疗的持续时间比抗生素治疗的持续时间长[15]。疗程结束后,患者的病情有所好转,停用特比萘芬15天后仍无临床症状。
本病例强调,及时识别猫脓胸的病原体并进行适当治疗对于预防严重并发症和致命后果至关重要。虽然大多数已知的猫侵袭性真菌感染并非人畜共患病,但人类与宠物之间的密切关系确实存在直接传播新出现的酵母菌的风险,这些酵母菌可能会导致危险的真菌感染,尤其是在免疫力低下的人群中。
文献来源:Garnoeva R, Dinkova V. Fungal Empyema Thoracis Associated with Clavispora lusitaniae-First Report in a Domestic Cat. J Fungi (Basel). 2025 Feb 20;11(3):170.
参考文献
1.Krämer F., Rainer J., Bali M.S. Short- and long-term outcome in cats diagnosed with pyothorax: 47 cases (2009–2018) J. Small Anim. Pract. 2021;62:669–676.
2.Sim J.J., Lau S.F., Omar S., Watanabe M., Aslam M.W. A retrospective study on bacteriology, clinicopathologic and radiographic features in 28 cats diagnosed with pyothorax. Animals. 2021;11:2286.
3.McCaw D., Franklin R., Fales W., Stockham S., Lattimer J. Pyothorax caused by Candida albicans in a cat. J. Am. Vet. Med. Assoc. 1984;185:311–312.
4.Barrs V.R., Allan G.S., Martin P., Beatty J.A., Malik R. Feline pyothorax: A retrospective study of 27 cases in Australia. J. Feline Med. Surg. 2005;7:211–222.
5.Arbona N., Butkiewicz C.D., Keyes M., Shubitz L.F. Clinical features of cats diagnosed with coccidioidomycosis in Arizona, 2004–2018. J. Feline Med. Surg. 2020;22:129–137.
6.Barrs V.R., Beczkowski P.M., Talbot J.J., Hobi S., Teoh S.N., Hernandez Muguiro D., Shubitz L.F., Sandy J. Invasive fungal infections and oomycoses in cats: 1. Diagnostic approach. J. Feline Med. Surg. 2024;26:1098612X231219696.
7.Denning D.W. Global incidence and mortality of severe fungal disease. Lancet Infect Dis. 2024;24:e428–e438.
8.Iqbal N., Ali A.S., Zahid A., Jabeen K., Irfan M. Fungal empyema thoracis, a rare but an emerging entity: A retrospective case series from Pakistan. Ther. Adv. Infect. Dis. 2024;11:20499361231223887.
9.Mendoza-Reyes D.F., Gómez-Gaviria M., Mora-Montes H.M. Candida lusitaniae: Biology, pathogenicity, virulence factors, diagnosis, and treatment. Infect. Drug Resist. 2022;15:5121–5135.
10.Haseeb U., Rasool M., Swaminathan G., Hosna A.U., Ishfaq. S., Trandafirescu T. Candida lusitaniae, an emerging opportunistic pathogen in immunocompetent populations: A case report. Cureus. 2023;15:e43211.
11.Amorim C.F., Antón A.R.S., Portela R.W. Perfil de sensibilidade a antifúngicos de Candida lusitaniae isolada de caso de peritonite felina. Rev. Ciênc. Méd. Biol. 2023;22:480–485.
12.Walker A.L., Jang S.S., Hirsch D.C. Bacteria associated with pyothorax of dogs and cats: 98 cases (1989–1998) J. Am. Vet. Med. Assoc. 2000;216:359–363.
13.Kotnik T., Kozuh Erzen N., Kuzner J., Drobnic-Kosorok M. Terbinafine hydrochloride treatment of Microsporum canis experimentally-induced ringworm in cats. Vet. Microbiol. 2001;83:161–168.
14.Camera E., Cannistraci C., Briganti S., Colombo D., Picardo M. Scavenging effects of terbinafine on free radicals in vitro. Br. J. Dermatol. 1999;140:640–644.
15.Renner K., Hill S., Grinberg A., Weeden A. Pancreatic candidiasis in a cat. J. Feline Med. Surg. Open Rep. 2021;7:20551169211052889.