
| 品种:长毛猫 | |
| 年龄:11岁 | |
| 性别:雌 | |
| 诊断:骨外骨肉瘤 | |
01 主诉及病史
两周前出现厌食,随后发展为嗜睡、呕吐和多食。
曾有呕吐毛球的病史,在过去几个月中,呕吐频率有所增加。5天前进行的常规生化检查发现碱性磷酸酶活性轻度升高(206 IU/L [10-90]),丙氨酸氨基转移酶活性升高(935 IU/mL [20-100]),总胆红素浓度明显升高(3.1 mg/dL [0.1-0.6])。接受了静脉输液、马罗吡坦、S-腺苷蛋氨酸(SAMe)、奥美拉唑、阿莫西林-克拉维酸和肠道喂养等支持性治疗。因症状未好转而转诊。
02 检查
神智清醒,反应灵敏,粘膜呈粉红色,毛细血管再充盈时间<2秒。直肠温度39°C,体重3.2千克,体况评分3/9,肌肉状况评分2/3。心动过速(240次/分),搏动平稳,心律规律,胸骨全收缩期杂音3/6级。
腹部触诊发现前腹部有一个坚实、不规则的肿块。血气分析显示轻度代谢性酸中毒(pH 7.297 [7.350-7.470],碱剩余4.9,HCO3 19.2 mmol/L)、轻度高钠血症(157 mmol/L [140-153])和游离钙轻度下降(1.26 mmol/L [1.28-1.43])。肌酐和尿素浓度正常(148 μmol/L和8.9 mmol/L)。红细胞压积为45%,总蛋白72克/升,血小板浓度正常。
腹部超声发现了一个部分矿化的肿块(直径约3.3厘米),环绕十二指肠(下图)。该肿块与邻近的胰腺无法区分,并伴有胃扩张。肝脏至少有两个相对不明确的病灶,宽度在3.5-7.4毫米之间。胆囊内有少量无阴影的淤积物和迂曲扩张的胆囊管,宽度为0.48厘米。有少量游离腹腔积液。
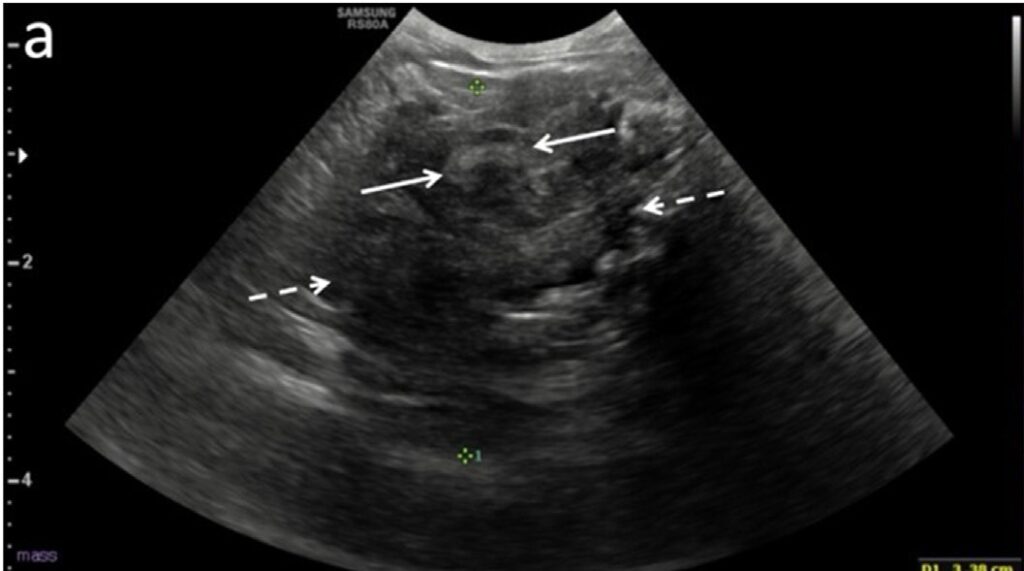
↑ 腹部超声显示肿块(虚线箭头)环绕十二指肠近端(箭头)。
肿块的细针穿刺结果显示,有核细胞较少,主要有核细胞群由单个或小的圆形或纺锤形、星状细胞聚集而成。细胞核呈圆形或椭圆形(直径10-15 μm),染色质细碎至粗糙,有单个至多个突出的核小体和中等量的嗜碱性细胞质,细胞质中常含有多个小空泡、少量至中等量的紫色小颗粒,通常还有一个远离细胞核的浅色染色区。有轻度至中度的异核和异丝分裂,偶见双核和多核(下图),还可见罕见的疑似有丝分裂图形和罕见的可能的红细胞吞噬。还观察到散在的罕见矿化灶和多条淡蓝色或绿色的线状物质(来源不明)。
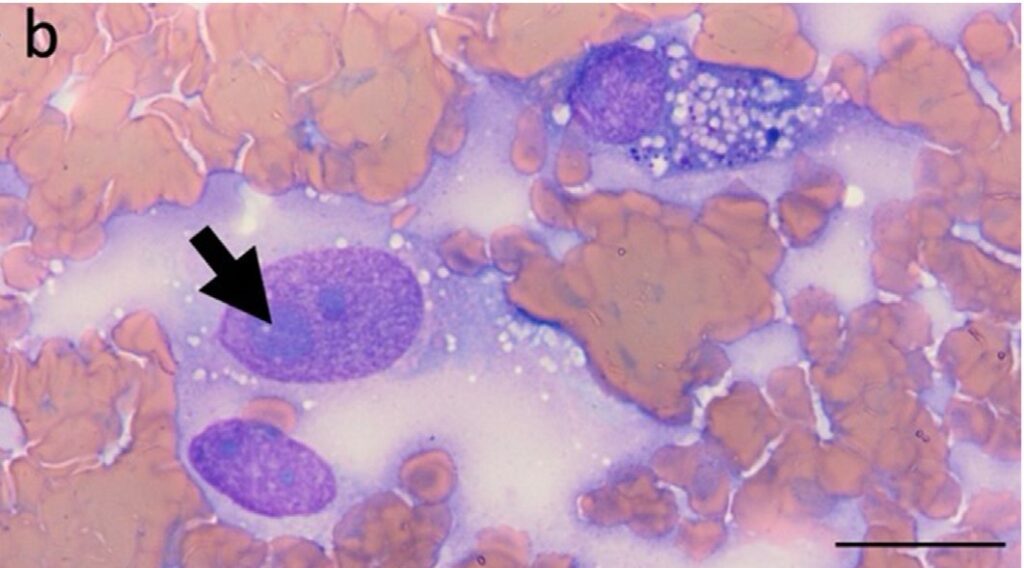
↑ 腹部肿块细针穿刺病理结果显示大块圆形的间质细胞,中度至明显的异形细胞增多、异形核、大核和多个大小不一的核仁(箭头)。
肝脏结节的细胞学检查发现了罕见的细胞,其形态与十二指肠肿块中描述的细胞相似,并发现了少量类似的结晶和线状物质。由于没有发现肝细胞,因此怀疑抽吸的肠系膜脂肪可能与腹部肿块的病理相似。
03 治疗
主人拒绝了进一步的检查,由于临床症状恶化和生活质量差,这只猫被安乐死。
04 预后
尸检发现一个累及十二指肠近端的肿块,并部分浸润了胰腺右叶的近端。肿块呈多分叶状,坚硬白色,直径15毫米(下图)。肿瘤浸润十二指肠壁,使管腔变窄,浸润胆管远端,胆囊轻度扩张,部分胆管梗阻。
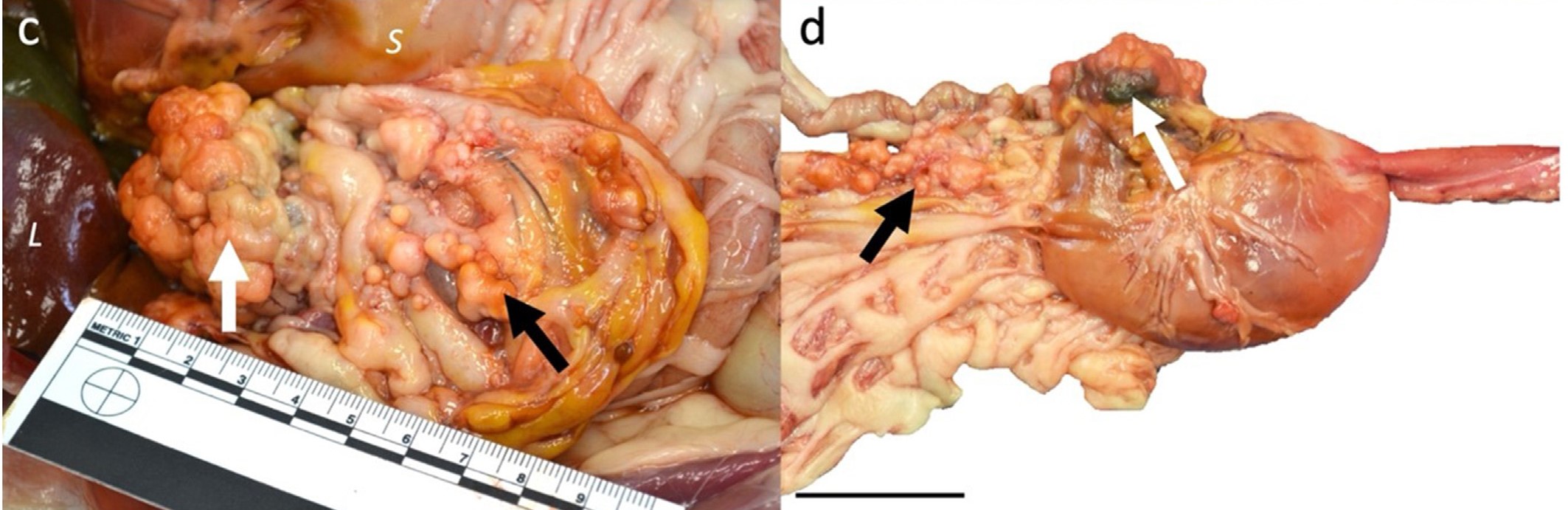
↑ 多分枝坚实肿块累及十二指肠近端肠壁(白色箭头),并出现在网膜上(黑色箭头)。L,肝脏;S,胃。
网膜、肝壁层浆膜(下图e)和胆囊壁浆膜上多发性可见多个非浸润性、白色、圆形、坚硬的结节,直径3-20 mm。膈肌壁有多个浸润性、圆形、黄褐色、坚硬的肿块,直径10-30 mm(下图f)。其他胸膜和内脏器官以及肌肉骨骼结构中均未发现可见肿块。
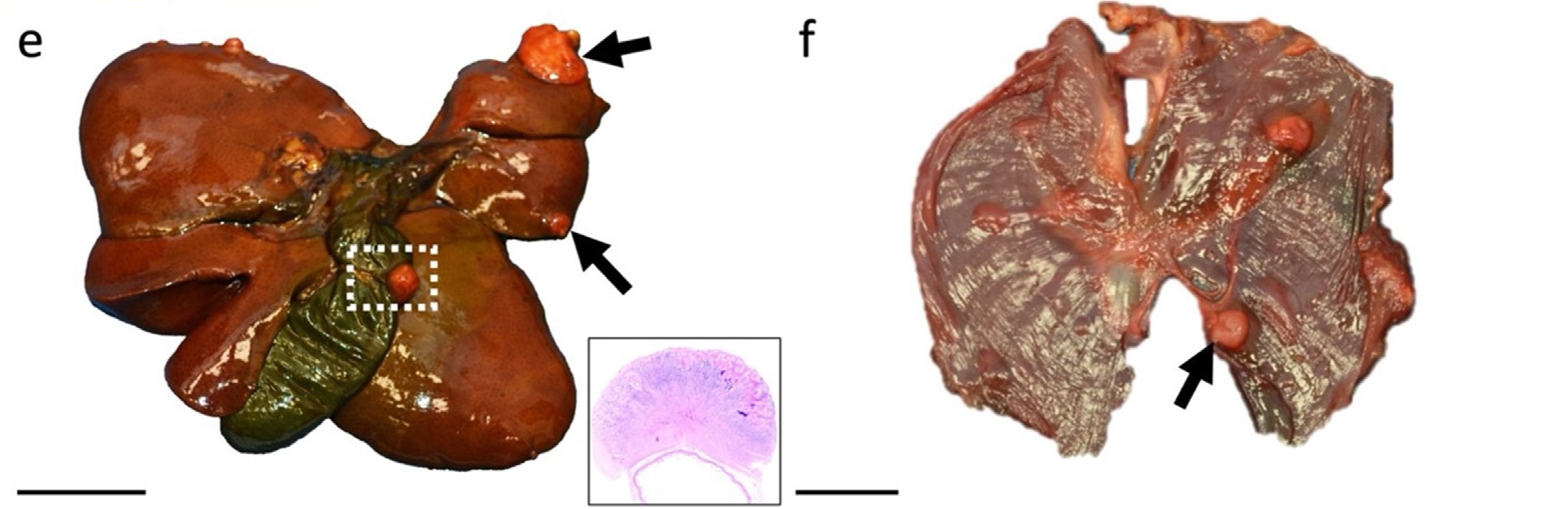
↑ 肝包膜(e)、胆囊浆膜(虚线框;插图:胆囊)和膈肌内侧(f)有多个白色、坚实、界限清楚的非侵入性肿块(箭头)。
显微镜检查显示,间充质细胞呈中度细胞增殖,类似于成骨细胞或软骨细胞,嵌套在软骨样和骨样基质中(下图ab)。Howship腔隙内存在许多类似破骨细胞的多核巨细胞。10个高倍视野中检测到两个有丝分裂象,有中度异胞和轻度异核。肿瘤细胞被大量的细胞外基质分离,从致密的嗜酸性纤维物质到强烈的嗜碱性均匀软骨样基质(下图c)或具有可变矿化的均匀嗜酸性骨样基质。肿瘤也表现出从结节外部富含软骨样基质向矿化骨样中心的过渡,类似于骨化(下图d)。这些发现符合II级骨肉瘤的诊断。
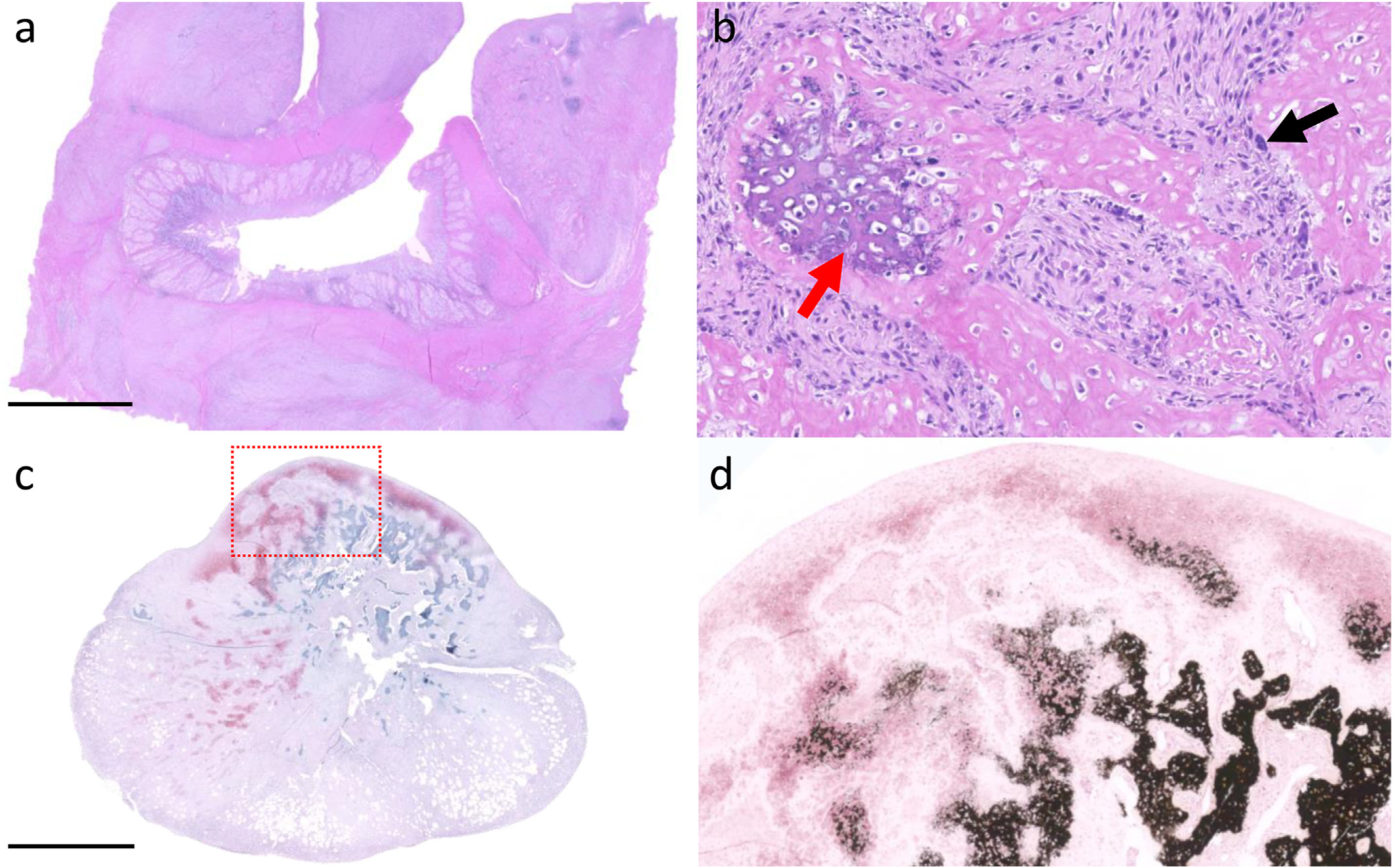
↑(a)十二指肠肌层周围扩张,并被间充质肿瘤所取代。(b)十二指肠肿块由不同矿化的类骨基质组成(红色箭头),散布着肿瘤性成骨细胞和偶尔的破骨细胞(黑色箭头)。(cd)网膜上由富含软骨样基质(c)组成的肿块向矿化的类骨中心过渡,类似于骨化(d)。
对十二指肠和胰腺进行免疫组织化学检查。大约90%的肿瘤细胞对波形蛋白有适度的细胞质免疫标记。细胞角蛋白、结蛋白、神经元特异性烯醇化酶或S100没有免疫标记。
05 讨论
骨外骨肉瘤(Extraskeletal osteosarcoma,ESOS)是一种罕见的侵袭性恶性肿瘤,发生于软组织而非原发性骨肿瘤。在猫的所有骨肉瘤(osteosarcoma,OS)病例中,ESOS约占40%,肿瘤可在不同解剖部位被发现,包括皮下组织、乳腺和眼/眶区域[1,2]。然而,发生在消化道,尤其是胃和十二指肠的ESOS非常罕见,只占猫OS病例的不到2% [1,2]。其他物种(如狗和人类)的ESOS发病率也同样很低[3,4]。
从组织学上看,猫OS通常具有成骨细胞特征,偶尔也有成纤维细胞或软骨细胞成分[1]。猫OS的转移率与狗相比相对较低[1],对于原发性消化道ESOS,仅有肠系膜淋巴结转移的报道[5,6]。在ESOS中,肉瘤通过腹膜播散的情况尚未见报道,仅有两例猫腹膜播散与肉瘤相关的报道[7,8]。
被确诊为ESOS的猫的预后通常很差,平均存活时间不到13个月[2]。在有限的涉及消化道的病例报告中,猫通常会在确诊后几周到几个月内被安乐死。不过,在个别病例中,手术干预将存活时间延长了数月[5,6,9]。例如,只接受活检的猫存活时间不到5个月,而接受切除活检的猫平均存活时间长达25个月[2]。
在人类肉瘤病中,接受根治性治疗的患者的中位生存期为76个月,而接受姑息治疗的患者的中位生存期为22个月[10]。继发于其他肉瘤的腹膜肉瘤猫的生存数据仅限于个别病例[7,8]。提高对猫腹膜肉瘤病的认识并改进检测对更好地了解生存结果和评估治疗策略至关重要。
在人类中,肉瘤最常见于胃肠道间质瘤、脂肪肉瘤和平滑肌肉瘤,这些都与不良预后有关[11,12]。在狗身上,一个小病例系列发现肉瘤可继发于原发性脾脏血管肉瘤(n=5)、软组织血管肉瘤(n=1)和肩胛骨OS(n=1)。这些狗都出现了腹膜结节,一例还出现了胸膜结节[13]。
本报告重点介绍了一例猫肠道ESOS继发的腹膜肉瘤,这种情况以前在该物种中没有报道。与超声和细胞学相关的诊断挑战强调了需要更先进的生前成像技术,如增强CT,以加强对原发性和播散性肿瘤的检测。虽然在这种情况下观察到轻微的腹膜积液,但其在区分肉瘤和癌症等疾病方面的诊断意义尚不清楚,需要更多的肉瘤病例进一步进行研究。
文献来源:Lean FZX, Haythornthwaite BJ, Broughton SE, Green JR, Llabres-Diaz F, Szladovits B, Martineau HM. Primary extraskeletal duodenal osteosarcoma with peritoneal sarcomatosis in a cat. J Comp Pathol. 2025 Apr 14;219:1-5.
参考文献
[1] M. Dimopoulou, J. Kirpensteijn, H. Moens, M. Kik. Histologic prognosticators in feline osteosarcoma: a comparison with phenotypically similar canine osteosarcoma. Vet Surg, 37 (2008), pp. 466-471.
[2] E. Heldmann, M.A. Anderson, C. Wagner-Mann. Feline osteosarcoma: 145 cases (1990–1995). J Am Anim Hosp Assoc, 36 (2000), pp. 518-521.
[3] A. Langenbach, M.A. Anderson, D.M. Dambach, K.U. Sorenmo, F.D. Shofer. Extraskeletal osteosarcomas in dogs: a retrospective study of 169 cases (1986–1996). J Am Anim Hosp Assoc, 34 (1998), pp. 113-120.
[4] H. Wang, R. Miao, A. Jacobson, D. Harmon, E. Choy, F. Hornicek, et al. Extraskeletal osteosarcoma: a large series treated at a single institution. Rare Tumors, 10 (2018), Article 2036361317749651.
[5] J. Huang, K.K. McFadden, A. Powers, A. Powers, A.L. Burnum, F. de Oliveira Conrado. What is your diagnosis? Fine-needle aspirate from an intestinal mass in a cat. Vet Clin Pathol, 51 (2022), pp. 444-448.
[6] E. Rouillé, N. Soetart, A. Drut, A. Abadie, L. Jaillardon. What is your diagnosis? Intestinal mass in a cat. Vet Clin Pathol, 51 (2022), pp. 157-160.
[7] C.B. Monteiro, R.T. O’Brien. A retrospective study on the sonographic findings of abdominal carcinomatosis in 14 cats. Vet Radiol Ultrasound, 45 (2004), pp. 559-564.
[8] M.E. White, C. Yang, J.A. Hokamp, M.L. Wellman. Fibrosarcoma with sarcomatosis and metastasis in a FeLV-negative cat. Vet Clin Pathol, 49 (2020), pp. 143-146.
[9] E.L. Stimson, W.T. Cook, M.M. Smith, S.D. Forrester, M.L. Moon, G.K. Saunders. Extraskeletal osteosarcoma in the duodenum of a cat. J Am Anim Hosp Assoc, 36 (2000), pp. 332-336.
[10] F. Klingler, H. Ashmawy, L. Häberle, I. Esposito, L. Schimmöller, W.T. Knoefel, et al. Treatment pathways and prognosis in advanced sarcoma with peritoneal sarcomatosis. Cancers, 15 (2023), p. 1340.
[11] M.M. Bilimoria, D.J. Holtz, N.Q. Mirza, B.W. Feig, P.W.T. Pisters, S. Patel, et al. Tumor volume as a prognostic factor for sarcomatosis. Cancer, 94 (2002), pp. 2441-2446.
[12] T.N. Oei, J.P. Jagannathan, N. Ramaiya, P.R. Ros. Peritoneal sarcomatosis versus peritoneal carcinomatosis: imaging findings at MDCT. AJR Am J Roentgenol, 195 (2010), pp. W229-W235.
[13] P.J. Weston, S.J. Baines, R. Finotello, J.R. Mortier. Clinical, CT, and ultrasonographic features of canine and feline pleural and peritoneal carcinomatosis and sarcomatosis. Vet Radiol Ultrasound, 62 (2021), pp. 331-341.