
| 病例1 | |
 | 品种:泰迪贵宾 |
| 年龄:9岁 | |
| 性别:雄 | |
| 是否绝育:的 | |
| 诊断:前列腺肿瘤 | |
01 主诉及病史
因血尿而被转诊。
之前医院进行的腹部超声发现前列腺肿块,并推测已侵入膀胱。
02 检查
体重6.3公斤。全血细胞计数未显示明显异常。血生化显示丙氨酸氨基转移酶轻度升高(140.36 U/L [19-70]),未发现其他异常。
腹部超声显示前列腺异型低回声增大并伴有矿化,最大矢状面为13.8×20.3毫米(下图AB)。膀胱颈部增厚,边缘不规则。膀胱肿块与前列腺肿块相连,边缘不规则并有矿化。
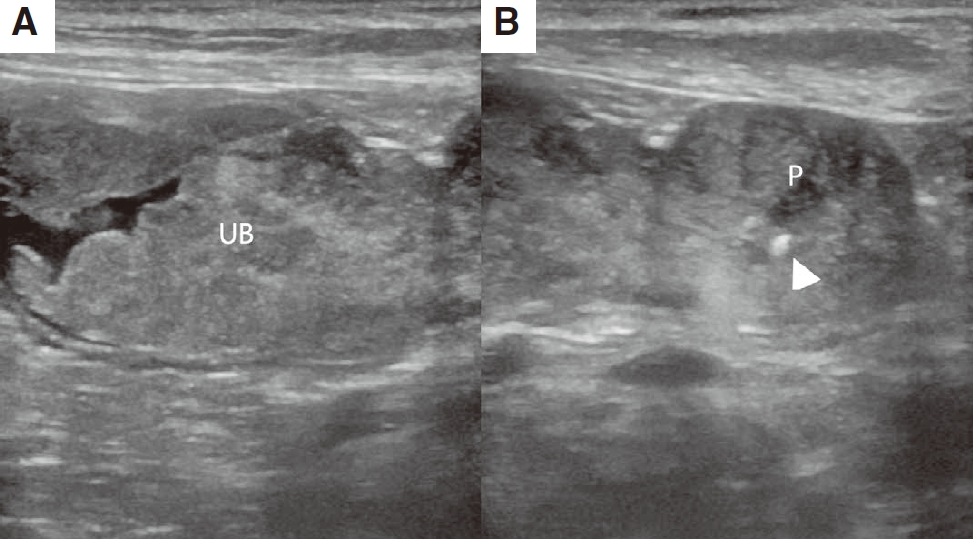
↑ (A-B)观察到一个轮廓不规则的异质性膀胱(UB)肿块,前列腺(P)增大并伴有灶性矿化(箭头所指)。
尿道导管插入后进行的尿液细胞学检查发现了大的多形性细胞,细胞核呈椭圆形。根据细胞学和超声结果,前列腺肿块被诊断为侵犯膀胱的前列腺癌。
CT扫描显示前列腺肿块与膀胱肿块相连,膀胱肿块也呈低至等度衰减。计算的肿瘤体积为16.94立方厘米(下图E)。
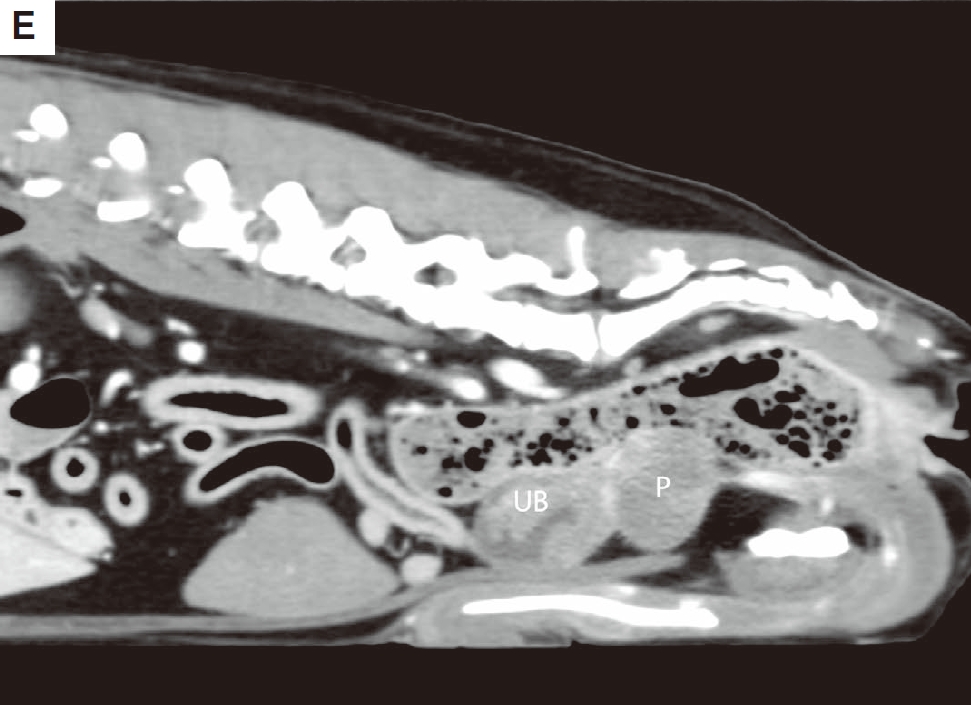
↑ (E)在矢状CT图像中,两个肿块看起来是连在一起的。UB,膀胱;P,前列腺。
| 病例2 | |
 | 品种:比熊犬 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:膀胱肿瘤 | |
03 主诉及病史
因诊断出膀胱肿瘤而转诊。
在之前的医院主诉是尿频和血尿。
04 检查
体重10.5千克。血液学发现有轻至中度再生性贫血(HCT 27.7% [37.3-61.7])。血小板计数处于正常范围的下限(185 k/μL [148-484])。血生化显示丙氨酸氨基转移酶水平(99.57 U/L [19-70])、血尿素氮(33.99 mg/dL [8-26])和空腹血糖(152 mg/dL [70-118])轻度升高。
腹部超声显示等回声至低回声异质实性膀胱肿块,血管明显(下图CD)。尿液细胞学检查显示簇状的大细胞、多角形细胞和圆形细胞具有较高的核浆比。使用排出的尿液进行犬BRAF基因突变检测,结果呈阳性。根据这些结果,确诊为尿路上皮癌。
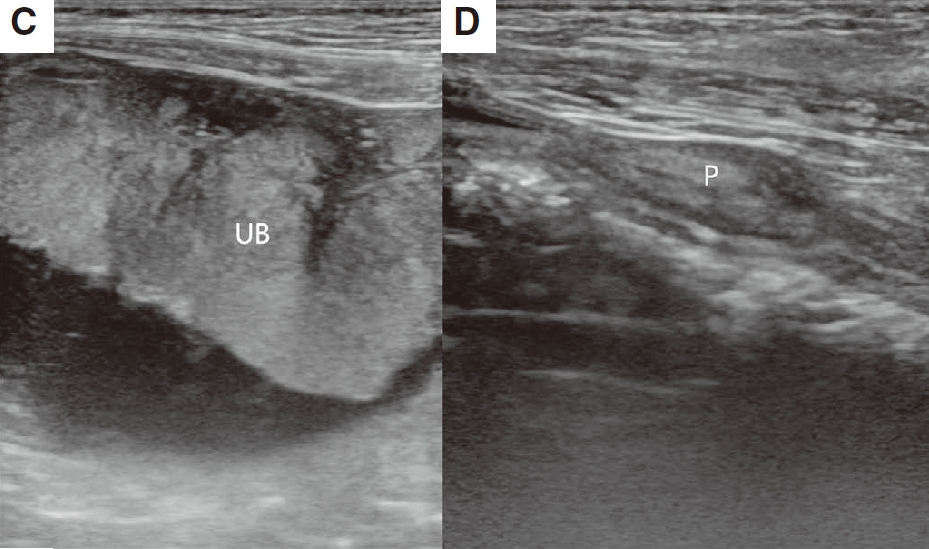
↑ (C-D)膀胱腹壁观察到等回声至高回声肿块,前列腺正常。UB,膀胱;P,前列腺。
CT扫描显示膀胱肿块未侵犯邻近器官,肿瘤体积为37.58立方厘米(下图F)。
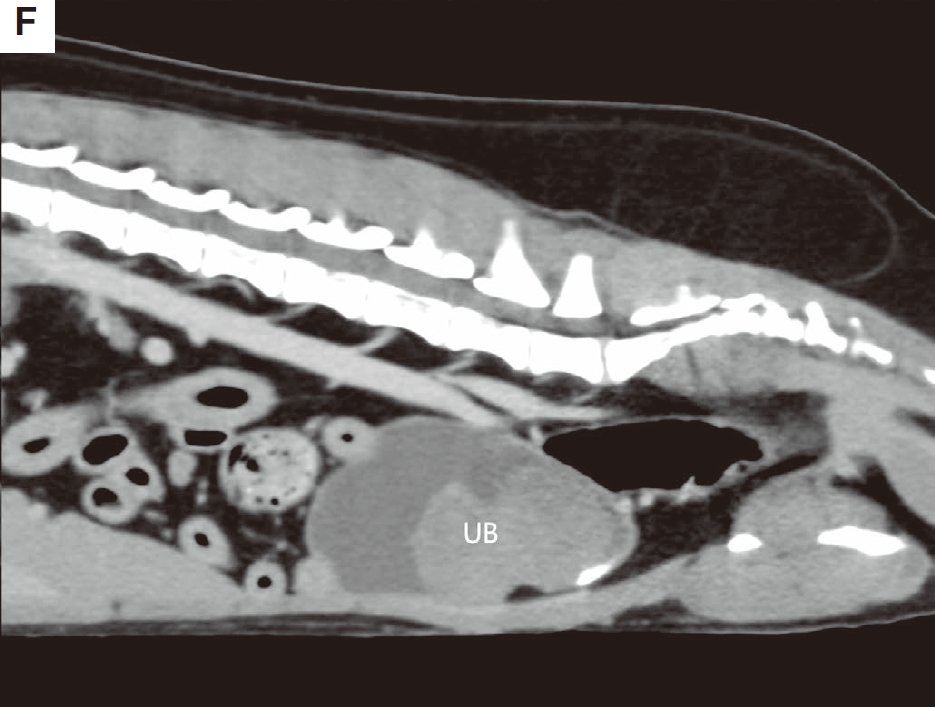
↑ (F)膀胱肿块位于腹壁。UB,膀胱。
发现一条从髂内动脉延伸出来的脐动脉,为膀胱肿块提供了血供(下图)。膀胱肿块的动脉供应来自双侧后膀胱动脉和脐动脉。
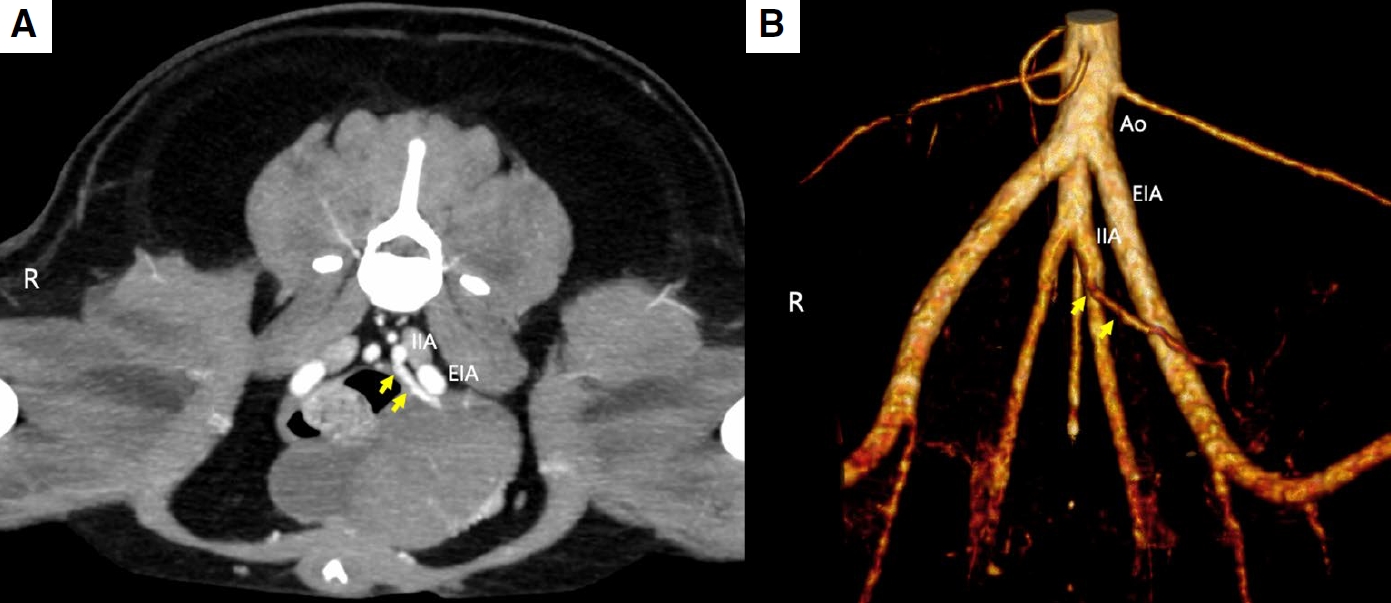
↑ 横向CT图像(A)和容积渲染图像(B)显示存在一条源自左侧髂内动脉(IIA)的脐动脉(黄色箭头)。Ao,主动脉,EIA,髂外动脉。
05 治疗
两只狗的经动脉栓塞术(TAE)均在全麻下进行。麻醉前进行了静脉注射:0.2 mg/kg地塞米松磷酸钠和25 mg/kg头孢唑啉钠。
使用5 Fr导引鞘,经颈动脉进行经动脉切开术。用一根0.035英寸的导丝通过颈动脉和胸主动脉导入一根4 Fr血管造影导管,导管到达后主动脉水平。
从血管造影导管中抽出导丝,在透视引导下注入3毫升造影剂,以观察末端主动脉的血管解剖结构。使用0.014英寸微导丝和1.5 Fr微导管对前列腺和后膀胱动脉进行选择,以进入髂内动脉和阴部内动脉。患者取侧卧位。随后注入1毫升造影剂,以划定前列腺和后膀胱动脉。
在病例1中,使用溶解在10 mL造影剂中的100-150 μm明胶海绵颗粒栓塞左右前列腺动脉和左右后膀胱动脉。对选定的血管进行栓塞。栓塞后进行髂内血管造影,以确保阻塞目标血管(下图A-C)。右侧前列腺和后膀胱动脉的栓塞剂溶液注入总量为0.4毫升,左侧前列腺和后膀胱动脉为0.6毫升。
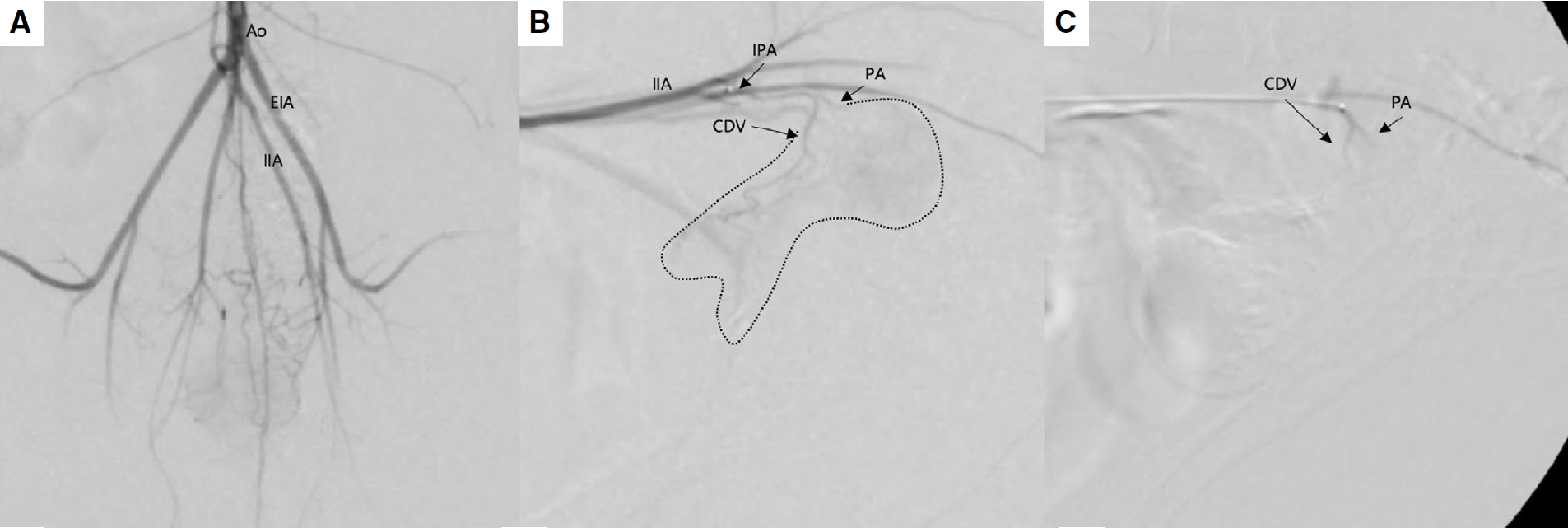
↑(A)远端主动脉(Ao)血管造影。(B) 右侧髂内动脉(IIA)血管造影显示前列腺动脉(PA)和后膀胱动脉(CDV)有肿瘤染色(黑色虚线)。(C)栓塞后的前列腺动脉血管造影显示肿瘤染色消失。EIA,髂外动脉,IPA,阴部内动脉。
在病例2中,由于动脉供应来自脐动脉,因此对双侧后膀胱动脉和脐动脉进行了栓塞手术。右侧后膀胱动脉注入的栓塞剂总量为0.4毫升,左侧后膀胱动脉为0.5毫升,脐动脉为2.0毫升。
↑(D)主动脉(Ao)血管造影显示脐动脉(虚线箭头)。(E)脐动脉血管造影显示肿瘤染色,并有迂曲的小血管(红色虚线)。(F)栓塞后的脐动脉血管造影显示肿瘤染色减弱(黄色虚线)。EIA,髂外动脉,IPA,阴部内动脉。
移除微导管和血管造影导管后,拔出导引鞘。结扎颈动脉,使用常规技术缝合皮肤。两只狗都从麻醉中恢复过来,没有出现并发症。
术后进行了密切监测,没有发现疼痛或出血等不良反应。为了控制手术后的不适并预防潜在的并发症,开具了以下药物:马罗吡坦(每天一次,每次2 mg/kg)、加巴喷丁(每天两次,每次10 mg/kg)、阿莫西林-克拉维酸(每天两次,每次12.5 mg/kg,持续一周)。
06 预后
TAE术后3天(病例1)和4天(病例2),包括血尿和尿频在内的症状均有明显改善。
TAE术后1个月,两例病例的肿瘤体积均有所缩小(下图)。病例1的肿瘤缩小了58%,为7.03立方厘米,病例2缩小了60.9%,为14.67立方厘米。病例2的贫血症状得到缓解,血小板水平恢复正常(334 k/μL)。
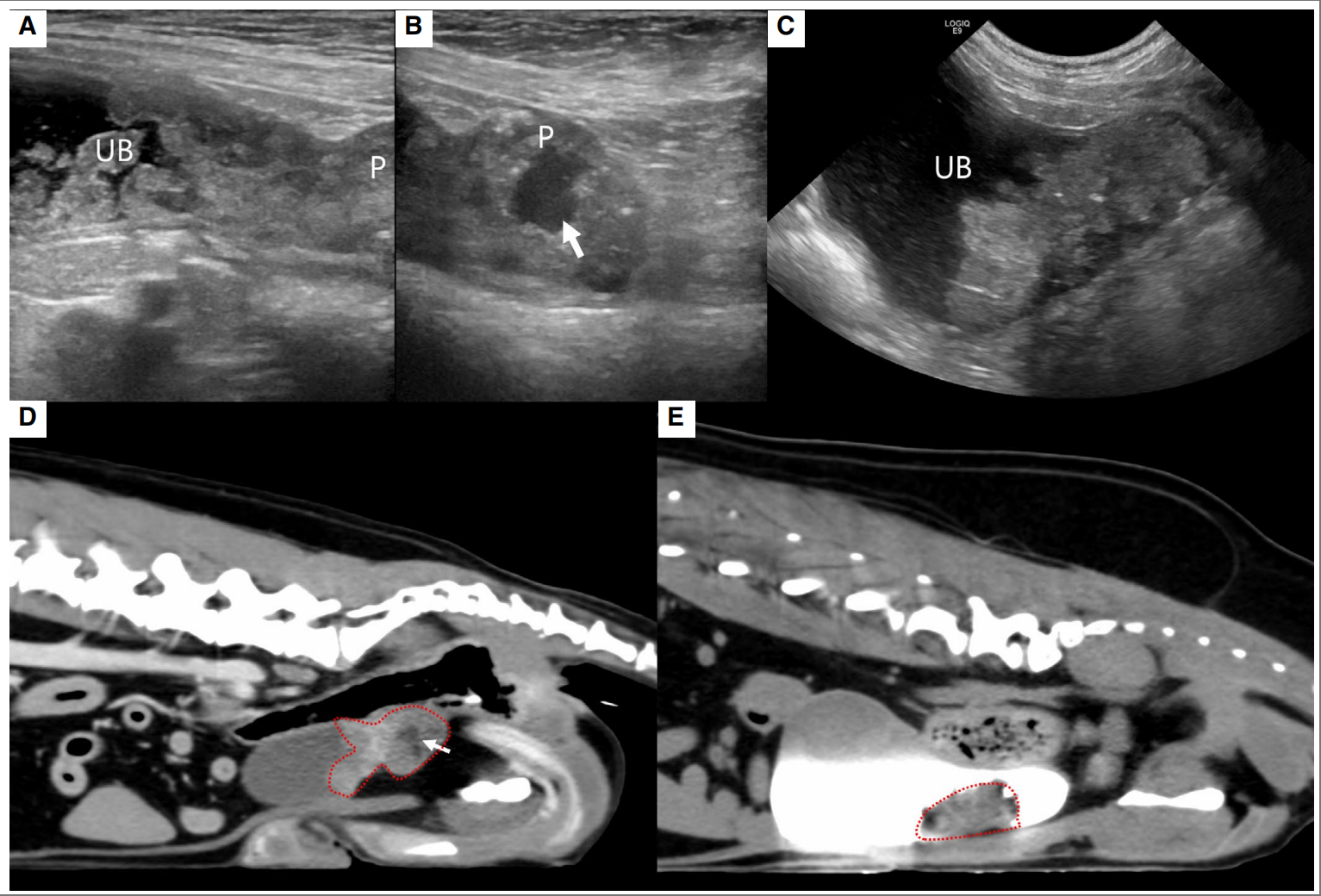
↑ 治疗后的超声(A-C)和CT图像(D-E):(ABD)病例1,膀胱(UB)和前列腺(P)肿块缩小。在两张图像中均观察到前列腺(箭头)有灶性坏死区。(CE)病例2,膀胱肿块明显缩小。
病例1在TAE术后,以3-4周的间隔开始静脉注射卡铂化疗。还每天口服0.3mg/kg吡罗昔康。
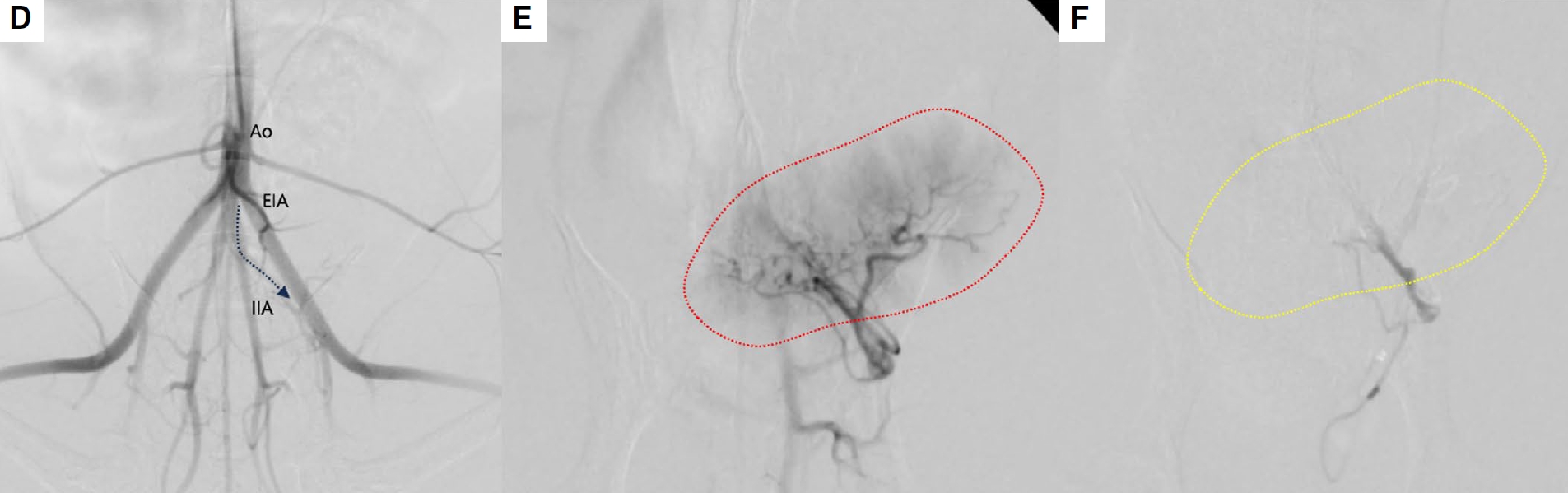
约6周后,病例1观察到血尿复发。因此使用相同的方法通过左股动脉进行了第二次TAE手术。在第二次手术的荧光透视中,与第一次手术相比,供应肿瘤的血管减少了(下图A)。
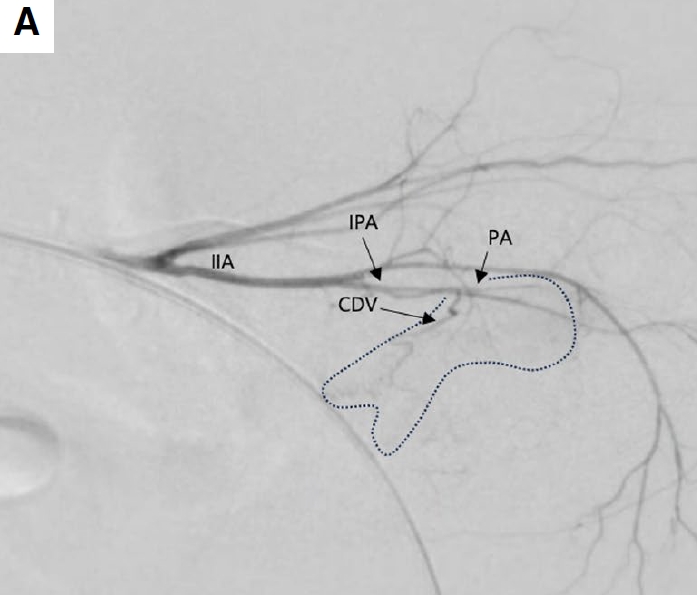
↑(A)右髂内动脉选择性血管造影。与第一次手术相比,供应肿瘤的小血管减少了,肿瘤染色的大小也减小了。CDV,后膀胱动脉;IIA,髂内动脉;IPA,阴部内动脉;PA,前列腺动脉。
病例1第二次TAE后,血尿消失,表明对治疗有积极反应。在第一次TAE后的第193天,由于存在肺转移和生活质量显著下降,主人选择了安乐死。在安乐死之前,血尿没有复发。
病例2中,主人拒绝了全身化疗和口服非甾体抗炎药。初次TAE后4周,血尿复发。使用相同的技术通过右颈动脉进行了第二次TAE手术。与之前的手术相比,供应肿瘤的小血管减少了,异常动脉选择性血管造影上的肿瘤染色也减少了(下图B)。
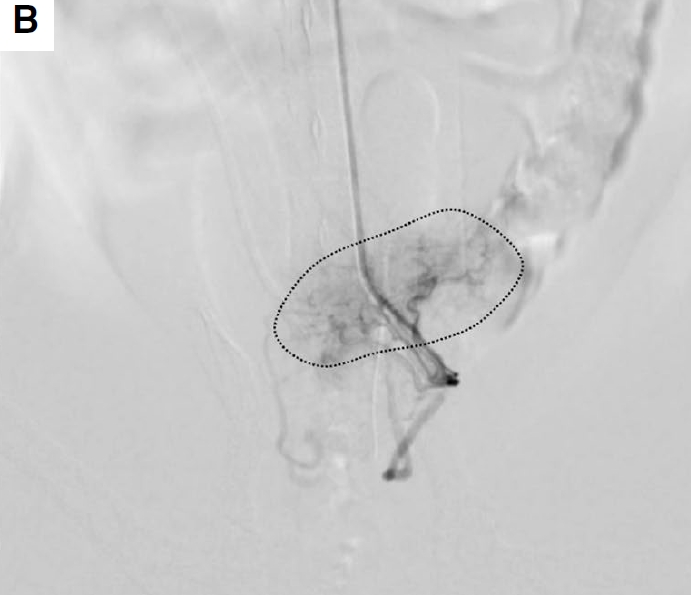
↑(B)左脐动脉选择性血管造影。与第一次手术相比,供应肿瘤的小血管减少了,肿瘤染色的大小也减小了。CDV,后膀胱动脉;IIA,髂内动脉;IPA,阴部内动脉;PA,前列腺动脉。
第二次TAE后,病例2的血尿再次消失,没有尿潴留的迹象。在第二次TAE后的第7周,轻度间歇性血尿再次出现。尽管如此,在撰写本手稿时,即第一次TAE后的352天,患者的整体状况仍保持稳定。
07 讨论
狗的下尿路恶性肿瘤是一种不常见的疾病,预后很差,最常见的是膀胱和尿道癌或前列腺癌(腺癌)[1-3]。与下尿路癌相关的临床症状包括血尿、尿失禁、排尿困难以及厌食和体重减轻等非特异性症状。
尿道、膀胱或前列腺肿瘤可导致尿道阻塞,造成尿潴留[1]。下尿路肿瘤的传统治疗方法包括手术、非甾体抗炎药、化疗、放疗或这些方法的组合[4]。
最近,动脉内给药化疗已成为犬下尿路癌传统疗法的替代疗法,与静脉化疗相比,其疗效更佳[5]。此外,有报道称前列腺动脉栓塞可减轻泌尿系统临床症状,缓解血尿并使肿瘤缩小[6]。
下尿路持续性血尿也被称为“顽固性血尿”,可能会危及生命,可由多种因素引起,包括凝血病、肿瘤、炎症和创伤[7,8]。从病史上看,治疗膀胱出血的人类患者通常采用手术剥离或血管结扎等侵入性方法[9]。
由人类下尿路恶性肿瘤引起的持续性血尿不适合手术治疗,或涉及麻醉禁忌的其他合并症,构成了威胁生命的重要问题。严重出血和无症状贫血的患者需要持续输血[10]。
虽然存在多种治疗方案,如急性出血的药物治疗、使用生理盐水、明矾、福尔马林或膀胱水力扩张剂进行膀胱冲洗,但这些方法并不总是有效的,而且外科手术可能会带来很高的发病风险[11,12]。
由于这些侵入性技术的相关风险,经动脉栓塞(TAE)、膀胱镜消融和放射治疗等微创手术已成为有价值的治疗选择[13]。TAE于1974年首次被描述,用于在其他疗法不可行的情况下治疗顽固性难治性出血[9,14,15]。
在兽医领域,TAE能有效控制持续性鼻出血、肝肿瘤、前列腺癌等[6,16]。一些人类临床前研究也探索了TAE在犬激素诱导的前列腺增生模型中的应用,表明一些犬的前列腺显著缩小,且无严重并发症[17]。尽管之前确实有将TAE用于犬前列腺癌的研究结果,但却没有关于将其用于犬膀胱癌的报告。因此,本报告首次描述了TAE在控制难治性血尿方面的应用。
在本报告所介绍的病例中,栓塞终点设置为血流接近停滞而不是完全停滞,以避免对膀胱壁的缺血性损伤。在一项人类TAE研究中,接近停滞是指血流减少,其中造影剂从栓塞血管中清除的时间比从相邻的非栓塞血管中清理的时间要长得多[18]。
尽管部分栓塞的有效性和持久性可能不如完全栓塞,但它可以相对减少缺血并发症,如膀胱坏死或非靶向栓塞。尽管母血管几乎血流停滞,但每位患者第二次手术的血管造影图像显示,由于肿瘤尺寸减小,供应肿瘤的小血管已经消失,肿瘤染色也减少了。
总之,TAE技术有利于治疗与下尿路癌相关的持续性血尿,并有可能控患者的肿瘤大小。虽然血尿可能会复发,但可以通过反复的TAE手术来解决。需要进一步的研究来评估长期肿瘤体积监测和生存益处。
文献来源:Jeon S, Lee G, Lee N, Chang D. Transarterial embolisation in the treatment of persistent haematuria in two dogs with lower urinary tract carcinoma. J Small Anim Pract. 2025 Mar 23.
参考文献
[1] Axiak, S.M. & Bigio, A. (2012) Canine prostatic carcinoma. Compendium: Continuing Education for Veterinarians, 34, E1–E5.
[2] Mutsaers, A.J., Widmer, W.R. & Knapp, D.W. (2003) Canine transitional cell carcinoma. Journal of Veterinary Internal Medicine, 17, 136–144.
[3] Norris, A.M., Laing, E.J., Valli, V.E., Withrow, S.J., Macy, D.W., Ogilvie, G.K. et al. (1992) Canine bladder and urethral tumors: a retrospective study of 115 cases (1980–1985). Journal of Veterinary Internal Medicine, 6, 145–153.
[4] Fulkerson, C.M. & Knapp, D.W. (2019) Tumors of the urinary system. In: D.M. Vail, D.H. Thamm & J.M. Liptak (Eds.) Withrow and MacEwen’s small animal clinical oncology, 6th edition. St. Louis, MO: Elsevier Health Sciences.
[5] Culp, W.T., Weisse, C., Berent, A.C., Reetz, J.A., Krick, E.L., Jackson, D.E. et al. (2015) Early tumor response to intraarterial or intravenous administration of carboplatin to treat naturally occurring lower urinary tract carcinoma in dogs. Journal of Veterinary Internal Medicine, 29, 900–907.
[6] Culp, W.T.N., Johnson, E.G., Giuffrida, M.A., Palm, C.A., Skorupski, K.A., Burton, J.H. et al. (2021) Procedural description and prospective evaluation of short-term outcome for the use of prostatic artery embolization in dogs with carcinoma of the prostate. Journal of the American Veterinary Medical Association, 259, 1154–1162.
[7] Forrester, S.D. (2004) Diagnostic approach to hematuria in dogs and cats. Veterinary Clinics of North America: Small Animal Practice, 34, 849–866.
[8] Weisse, C., Clifford, C.A., Holt, D. et al. (2002) Percutaneous arterial embolization and chemoembolization for treatment of benign and malignant tumors in three dogs and a goat. Journal of the American Veterinary Medical Association, 221, 1430–1436 1419.
[9] Niekamp, A., Sheth, R.A., Kuban, J. et al. (2017) Palliative embolization for refractory bleeding. Semin Intervent Radiol, 34, 387–397.
[10] Abt, D., Bywater, M., Engeler, D.S. & Schmid, H.P. (2013) Therapeutic options for intractable hematuria in advanced bladder cancer. International Journal of Urology, 20, 651–660.
[11] Choong, S.K., Walkden, M. & Kirby, R. (2000) The management of intractable haematuria. BJU International, 86, 951–959.
[12] Hekimoglu, A., Ergun, O. & Hekimoglu, B. (2023) Selective transarterial embolization for intractable hematuria due to bladder carcinomas: a single-center experience. Urology Research and Practice, 49, 334.
[13] Pereira, J. & Phan, T. (2004) Management of bleeding in patients with advanced cancer. The Oncologist, 9, 561–570.
[14] Chen, C., Kim, P.H., Shin, J.H., Yoon, K.W., Chung, M.S., Li, H.L. et al. (2021) Transcatheter arterial embolization for intractable, nontraumatic bladder hemorrhage in cancer patients: a single-center experience and systematic review. Japanese Journal of Radiology, 39, 273–282.
[15] Hald, T. & Mygind, T. (1974) Control of life-threatening vesical hemorrhage by unilateral hypogastric artery muscle embolization. The Journal of Urology, 112, 60–63.
[16] Kawamura, Y., Itou, H., Kida, A., Sunkawa, H. & Kawamura, K. (2021) Case report: transcatheter arterial embolization for the initial management of intra-abdominal hemorrhage from a hepatic tumor in a cat. Frontiers in Veterinary Science, 8, 707120.
[17] Sun, F., Sanchez, F.M., Crisostomo, V., Díaz-Güemes, I., López-Sánchez, C., Usón, J. et al. (2011) Transarterial prostatic embolization: initial experience in a canine model. American Journal of Roentgenology, 197, 495–501.
[18] Lee, M., Chung, J.W., Lee, K.H., Won, J.Y., Chun, H.J., Lee, H.C. et al. (2017) Korean multicenter registry of transcatheter arterial chemoembolization with drug-eluting embolic agents for nodular hepatocellular carcinomas: six-month outcome analysis. Journal of Vascular and Interventional Radiology, 28, 502–512.