
| 一般情况 | |
 | 品种:罗威纳犬 |
| 年龄:10周 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:脊柱肿瘤 | |
01 主诉及病史
4天前出现进行性后肢共济失调和腰骶部疼痛。
02 检查
神志清醒。不能行走(下图a),但能够站立并在搀扶的情况下承受一些重量。触摸腰部时有明显的疼痛反应。颅神经测试正常。双后肢感觉减弱,左侧更严重(下图b)。脊髓反射均正常,能够自主大小便。怀疑T3-L3脊髓病变。
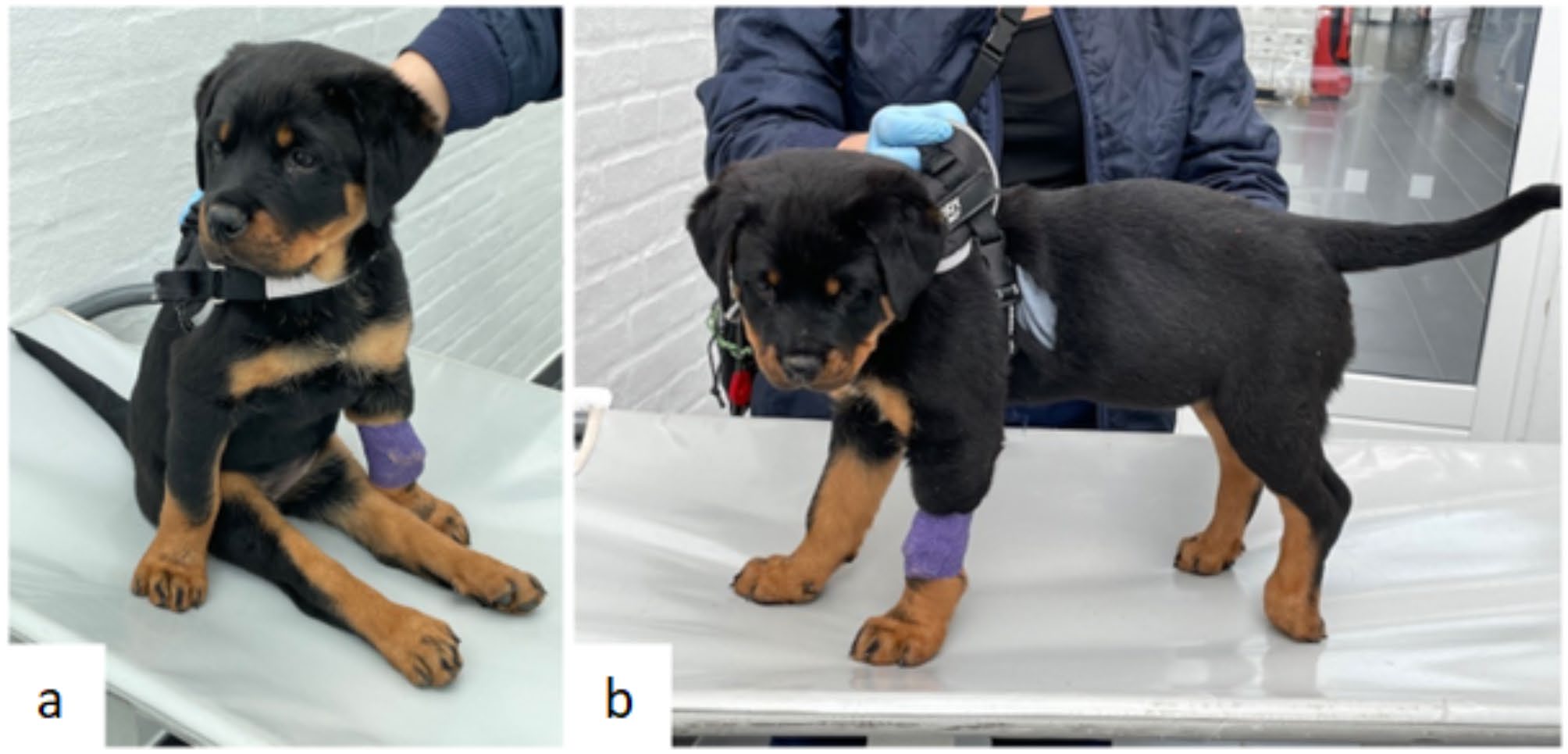
↑ 该幼犬表现为无法行走的瘫痪(a),后肢本体感觉下降(b)。
血液学检查显示轻度贫血和轻度单核细胞增多。生化指标无异常。在进行MRI之前,对腰骶部区域进行了X光检查,以排除脊柱骨折,结果发现X光片无异常。
MRI发现一个卵圆形、边缘清晰的肿块,从L3椎体中部延伸至L4椎体尾部。肿块以L4左侧椎弓根为中心,延伸至同侧椎孔内和L4椎体左侧背侧。与正常脊髓相比,肿块在T2加权序列上呈均匀高密度,在T1加权序列上呈异质等密度至高密度(下图)。肿块似乎浸润了椎弓右背侧和L4椎弓根,骨信号强度降低。肿块大小为2.8×1.3×1.1厘米,最大部分占据椎管横截面积的75%,导致椎管局灶性右移,脊髓受到中度压迫。蛛网膜下腔头端和尾端明显增宽。肿块在椎旁延伸,穿过L3-L5左侧椎间孔。脊柱旁组织呈中度异质对比增强,椎管内肿块的头侧和尾侧可见脑膜强化。根据影像学检查,肿块的定位主要是硬膜内-髓外,并伴有硬膜外成分。影像学诊断为软组织肿瘤伴骨质侵犯。
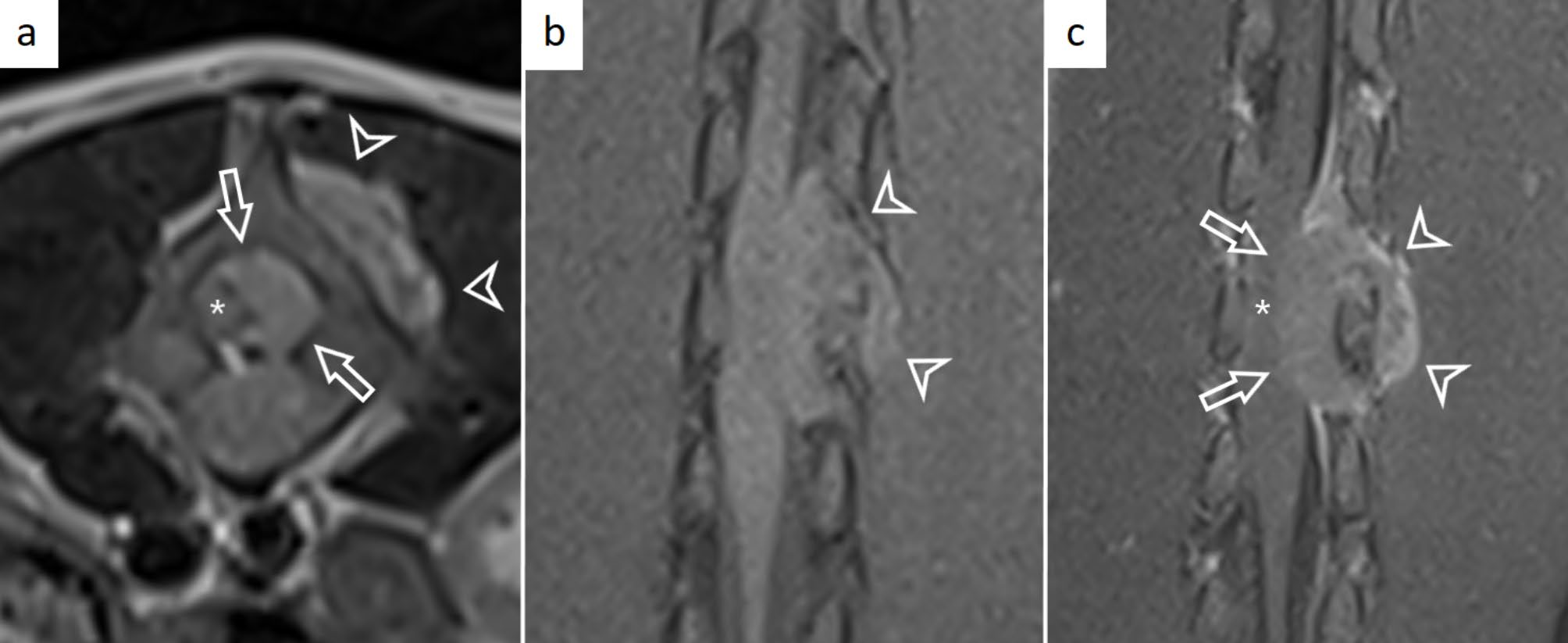
↑ L4椎体水平的横向T2加权图像(a)和脊髓水平的背侧T1加权图像对比前(b)和对比后(c),可见硬膜外肿块涉及左侧L4椎弓根。肿块在T2加权呈高密度(a),在T1加权与脊髓等密度(b),中度、异质性对比增强,伴有脑膜增强的“硬膜尾”征(c)。肿块伸入椎管(白色箭头)和左背外侧(白色三角)。肿块向右侧移位并压迫脊髓(星号)。
03 治疗
由于肿块范围较大,并涉及骨骼,因预后不良而被实施安乐死。
04 尸检
除腰部病变外均无异常。切片检查发现在L3-L4位置有一个硬膜外苍白软组织肿块,使脊髓脱位并充满椎管。L3椎弓(尤其是左侧)几乎完全缺失,被软组织肿块取代。肿块向背侧扩展,导致背长肌深部萎缩。肿块的大部分区域轮廓清晰,椎管和椎弓的轮廓基本保持不变(下图)。
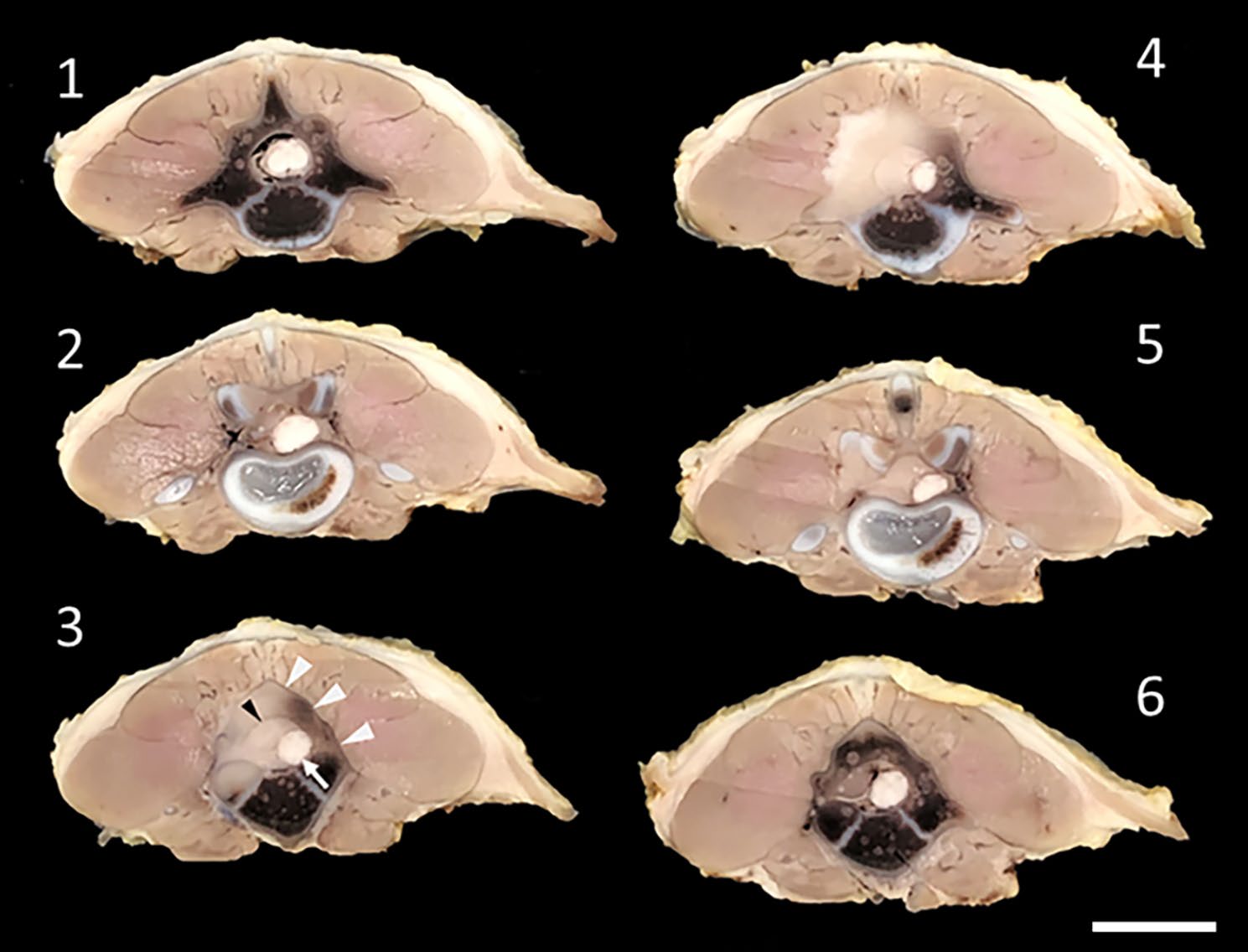
↑ 腰部从头(1)到尾(6)方向的4毫米横切面。椎管内有一个苍白的软组织肿块,导致脊髓错位(3中白色箭头)。椎管轮廓保持不变(3中黑色箭头)。肿块向背侧扩展,主要向左侧扩展,并伴有椎弓破坏。椎弓轮廓基本保持不变(3中白色箭头)。注意与周围肌肉的明显边界。
组织学上认为,肿瘤起源于硬膜外,穿过骨膜并扩展到椎骨骨小梁,其中一些区域已经坏死。肿瘤由单个多形性圆形至略带棱角的细胞组成。瘤细胞未嵌入基质(下图)。与内皮细胞相比,瘤细胞体积中等或较大,有少量嗜碱性细胞质,核胞比大于3:1,核小体频繁出现,数量和大小各异。有些核小体非常大,平均每10个视野中有29个有丝分裂象。脑、其他脊髓节段和其他组织均无异常。
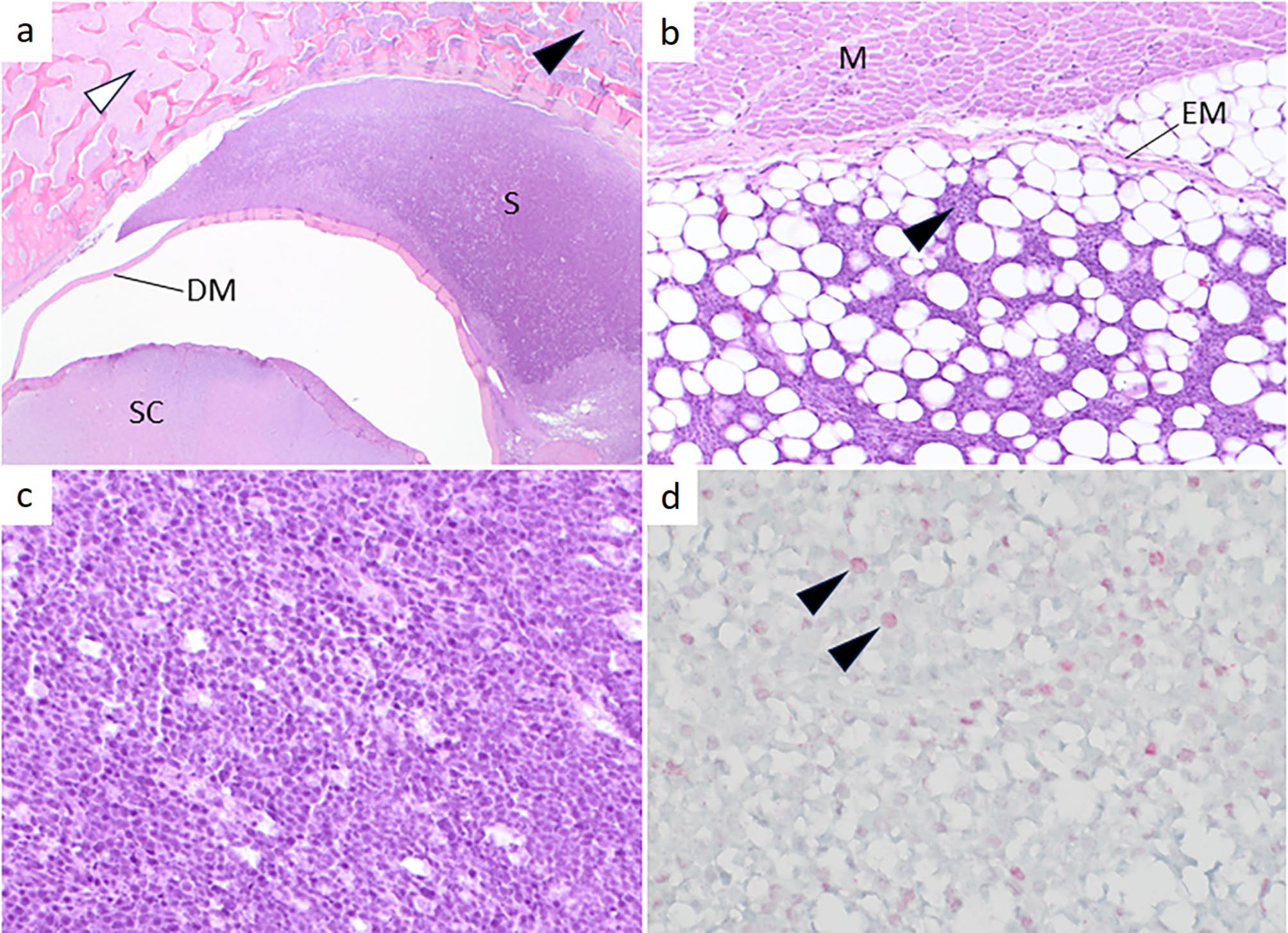
↑ (a)肉瘤(S)的硬膜外定位非常明显。脊髓(SC)和硬脑膜(DM)均未被肿瘤细胞浸润,但肿瘤已向周围扩展,肿瘤细胞已完全取代了某些部位的骨髓(黑色箭头)。白色箭头所指为非肿瘤性骨髓。(b)位于椎骨和背阔肌之间的脂肪组织(M)被肿瘤细胞浸润(黑色箭头),但完整的外膜仍然是肿瘤细胞浸润肌肉的屏障。(c)高倍放大图显示肿瘤由均匀的多形性圆形至略带棱角的细胞组成,有少量嗜碱性细胞质,无基质。(d)增殖标记物Ki-67的免疫组化染色。约14%的细胞核内有粉红色(阳性)染色(黑色箭头)。
免疫组化检测除了约14%的增殖标记物Ki-67阳性外,肿瘤细胞的所有反应均为阴性(上图)。根据组织形态学和免疫组化染色模式,该肿瘤被诊断为分化不良的圆形细胞肉瘤。
05 讨论
在出现脊髓疾病的狗中,脊髓肿瘤约占9%[1]。临床发病一般为亚急性慢性,可能包括脊髓感觉减退和神经功能缺损[1-3]。脊髓肿瘤在中老年大型犬中的发病率很高[1, 4-8],但在幼年和青年犬中的发病率却很低。
两项回顾性研究分别调查了29只和27只患有脊柱肿瘤的犬,结果发现只有3只犬的年龄小于7个月[9-10]。另一项回顾性研究调查了60只年龄在5个月到13岁之间的犬的硬膜外脊柱肿瘤的MRI特征,但没有说明有多少犬是幼年犬[2]。同一研究发现,圆形细胞瘤是第二常见的肿瘤类型,小型肿瘤比中型或大型肿瘤更常见[2]。
目前还没有关于幼犬脊柱肿瘤的大型调查报告。病例报告或小型病例系列包括肾母细胞瘤[11-12]、原始神经外胚层瘤[13-14]、胶质瘤[15]、肉瘤[16-18]和骨软骨瘤[19-21]。
在人类中,圆形细胞肉瘤是典型的高级别肿瘤,由于分化较差,可能难以诊断[22]。最常见的圆形细胞肉瘤——尤文氏肉瘤是儿童第二大肉瘤,甚至可在婴儿期出现[23-24]。约80%的肿瘤来自骨骼,20%来自软组织[22]。
根据《2020年世界卫生组织软组织肿瘤分类》,这些肿瘤的鉴别诊断相当广泛,圆细胞肉瘤包括肺泡横纹肌肉瘤、脱瘤性小圆细胞瘤、分化差的圆细胞滑膜肉瘤、小细胞骨肉瘤和间质软骨肉瘤[25]。
尽管最初怀疑MRI显示肿瘤位于硬膜内,但尸检结果显示肿瘤位于硬膜外。最近,人类医学界对成像定位与实际肿瘤定位之间的差异进行了研究,发现放射科医生最常将侵犯多个部位的肿瘤误定位。硬膜外肿瘤有时也会被误诊为硬膜内肿瘤[26]。
尽管很少有报道,但当年轻患者出现脊髓神经症状时,必须考虑肿瘤,尽管其他原因如外伤、先天性畸形和炎症性疾病的可能性更大。年轻的罗威纳犬也曾出现过多种神经和神经肌肉退化性疾病和综合征[27],但这些疾病和综合征都不符合本病例的临床表现。
本病例报告强调了对急性进行性骨髓病(即使是幼犬)进行MRI检查的重要性。争取早期发现可以避免预后不良的病例遭受不必要的痛苦,或在可能的情况下帮助指导治疗方案。
文献来源:Kristiansen KV, Schrøder AS, Bienzle D, Vedel T, Agerholm JS, Berendt M. Lumbar round cell sarcoma in a 10-week-old rottweiler puppy. Acta Vet Scand. 2025 Mar 12;67(1):12.
参考文献
1.Cardy TJA, De Decker S, Kenny PJ, Volk HA. Clinical reasoning in canine spinal disease: what combination of clinical information is useful? Vet Rec. 2015;177:171.
2.Auger M, Hecht S, Springer CM. Magnetic resonance imaging features of extradural spinal neoplasia in 60 dogs and seven cats. Front Vet Sci. 2021;7:610490.
3.Bagley RS. Spinal neoplasms in small animals. Vet Clin North Am Small Anim Pract. 2010;40:915–27.
4.Besalti O, Caliskan M, Can P, Vural SA, Algin O, Ahlat O. Imaging and surgical outcomes of spinal tumors in 18 dogs and one Cat. J Vet Sci. 2016;17:225.
5.Hanot EM, Cherubini GB, Marçal VC, Caine A. MRI features of solitary vertebral masses in dogs: 20 cases (2010–2019). J Am Anim Hosp Assoc. 2021;57:189–98.
6.Lacassagne K, Hearon K, Berg J, Séguin B, Hoyt L, Byer B, et al. Canine spinal meningiomas and nerve sheath tumours in 34 dogs (2008-2016): distribution and long‐term outcome based upon histopathology and treatment modality. Vet Comp Oncol. 2018;16:344–51.
7.Lopes BA, Ives EJ, José-López R, Gutierrez-Quintana R, Abouzeid J, Freeman P, et al. Cranial thoracic myelopathies (T1-T6 vertebrae): retrospective evaluation of the signalment, clinical presentation, and, presumptive or final diagnoses in 84 dogs. Front Vet Sci. 2022;9:960912.
8.Valentim LG, Marcasso RA, Bracarense APFL, Arias MVB. Spinal neoplasm in dogs. Acta Sci Vet. 2016;44:10.
9.Wright JA. The pathological features associated with spinal tumours in 29 dogs. J Comp Pathol. 1985;95:549–57.
10.Luttgen PJ, Braund KG, Brawner WR, Vandevelde M. A retrospective study of twenty-nine spinal tumours in the dog and Cat. J Small Anim Prac. 1980;21:213–26.
11.Brewer DM, Cerda-Gonzalez S, Dewey CW, Diep AN, Van Horne K, McDonough SP. Spinal cord nephroblastoma in dogs: 11 cases (1985–2007). J Am Vet Med Assoc. 2011;238:618–24.
12.Liebel F, Rossmeisl JH, Lanz OI, Robertson JL. Canine spinal nephroblastoma: Long-term outcomes associated with treatment of 10 cases (1996–2009). Vet Surg. 2011;40:244–52.
13.Hespel A, De Swarte M, Anderson K, Weiss R, Hathcock J. Features of a rare peripheral primitive neuroectodermal tumour arising from the thoracic spine in a juvenile canine patient. Vet Med Sci. 2021;7:680–5.
14.Junginger J, Röthlisberger A, Lehmbecker A, Stein VM, Ludwig DC, Baumgärtner W, et al. Peripheral primitive neuroectodermal tumour in a dog. J Comp Pathol. 2013;149:424–8.
15.Dos Santos EC, Summers BA, Elbert JA, Miller DM, Rissi DR. Canine glioma in the first year of life: 5 cases. J Vet Diagn Invest. 2024;36:579–82.
16.Hoon-Hanks LL, Frank CB, Edmondson EF. Primary meningeal rhabdomyosarcoma of the spinal cord of a young dog with neuromelanocytosis and multiple cutaneous neurofibromas. J Comp Pathol. 2018;165:57–61.
17.Hopkins AL, Garner M, Ackerman N, Chrisman CL, Eskin T. Spinal meningeal sarcoma in a rottweiler puppy. J Small Anim Pract. 1995;36:183–6.
18.Wright JA. An undifferentiated sarcoma affecting the first three cervical vertebrae of a puppy. J Small Anim Pract. 1978;19:267–71.
19.Menchetti M, Morini M, Pisoni L, Gagliardo T, Cinti F, Bettini G, et al. Pathology in practice. J Am Vet Med Assoc. 2018;252:423–5.
20.Ness M. Osteochondroma causing progressive posterior paresis in a Lakeland terrier puppy. Vet Rec. 1993;132:608–9.
21.Santen DR, Payne JT, Pace LW, Kroll RA, Johnson GC. Thoracolumbar vertebral osteochondroma in a young dog. J Am Vet Med Assoc. 1991;199:1054–6.
22.Le Loarer F, Baud J, Azmani R, Michot A, Karanian M, Pissaloux D. Advances in the classification of round cell sarcomas. Histopathology. 2022;80:33–53.
23.De Ioris MA, Prete A, Cozza R, Podda M, Manzitti C, Pession A, et al. Ewing sarcoma of the bone in children under 6 years of age. PLoS ONE. 2013;8:e53223.
24.Huh WW, Daw NC, Herzog CE, Munsell MF, McAleer MF, Lewis VO. Ewing sarcoma family of tumors in children younger than 10 years of age. Pediatr Blood Cancer. 2017;64:e26275.
25.Sbaraglia M, Bellan E, Dei Tos AP. The 2020 WHO classification of soft tissue tumours: news and perspectives. Pathologica. 2020;113:70–84.
26.Won YI, Choi Y, Yuh WT, Kwon SW, Kim CH, Yang SH, et al. Validity of magnetic resonance imaging (MRI) in the primary spinal cord tumors in routine clinical setting. Sci Rep. 2022;12:10151.
27.Davies DR, Irwin PJ. Degenerative neurological and neuromuscular disease in young rottweilers. J Small Anim Pract. 2003;44:388–94.