
| 一般情况 | |
 | 品种:欧洲短毛猫 |
| 年龄:5个月 | |
| 性别:未知 | |
| 是否绝育:否 | |
| 诊断:动脉导管未闭 | |
01 主诉及病史
因心脏杂音被转诊评估。
02 检查
没有任何症状。心脏左侧有5/6级连续性杂音。股动脉脉搏强劲,脉率160次/分。超声心动图显示左心室和心房中度扩张(左心房最大直径20毫米),左心室收缩功能和二尖瓣正常(下图)。在右侧胸骨旁短轴切面上,根据二维图像怀疑存在动脉导管未闭(PDA)。
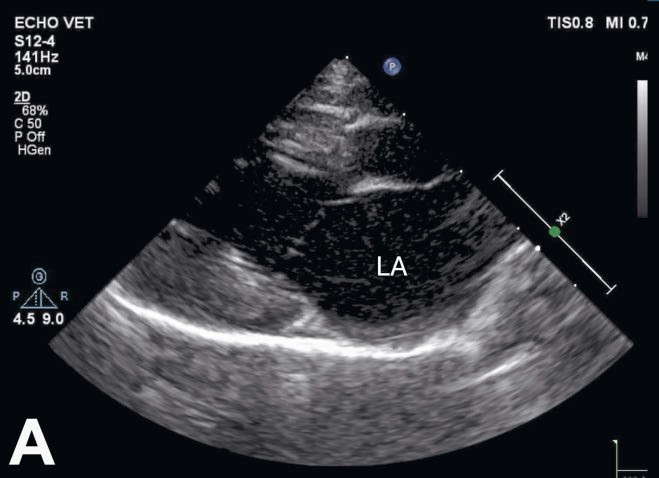
↑ 介入治疗前,左心房(LA)出现扩张(20毫米)。
彩色多普勒检查显示,PDA上有持续的血流,并伴有左向右分流(下图)。还发现了轻度二尖瓣关闭不全,这是由于PDA导致的血容量超负荷引起的。未发现其他异常。
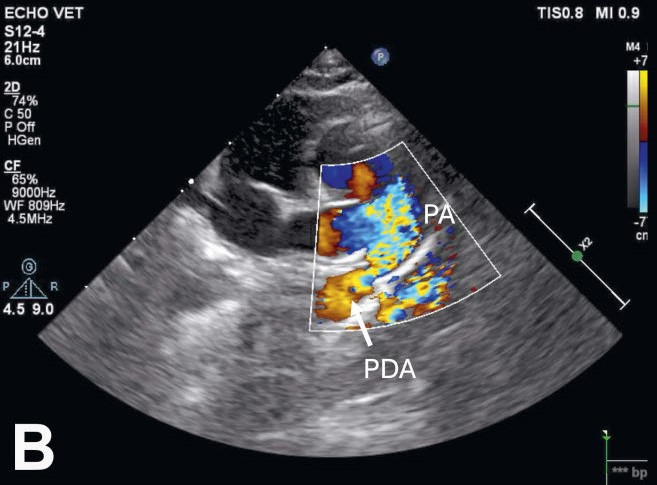
↑ PDA呈漏斗状管状结构(箭头)。彩色多普勒可见血流从PDA流向主肺动脉(PA)。
建议主人进行经血管内栓塞或开胸手术结扎,他们决定选择前者。4周后计划对PDA进行微创闭塞。当时体重为3.2千克。
03 治疗
麻醉后右侧卧位,通过切口进入右股血管。由于股动脉较小,因此采用改良的Seldinger技术准备股静脉,以便进行心导管检查。使用20G穿刺针导管穿刺静脉,然后用一根45厘米长的软导丝将导管与4 Fr血管导入器交换。
使用儿科探头进行了经食道超声心动图检查。PDA呈漏斗状,最小部位直径为1.3毫米,最大部位直径为4毫米。彩色多普勒显示PDA有持续的分流(下图)。
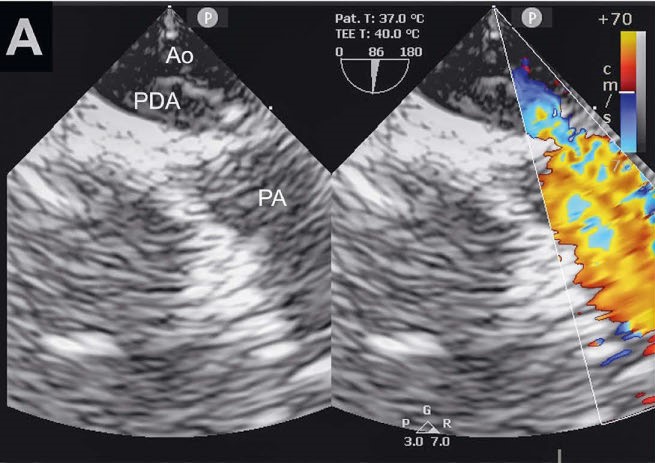
↑ 二维灰度和彩色多普勒联合图像显示PDA长轴,有分流液流入肺动脉(PA)。
在透视引导下,使用一根65厘米长、4 Fr的主肺动脉导管逆行导入PDA,经过后腔静脉、右心房、右心室、肺动脉、PDA,最后进入降主动脉。用一根(0.035 英寸)145厘米长的导丝将肺动脉导管和短导引管与一根4 Fr、55厘米长的鞘管交换,鞘管的尖端插入降主动脉。
根据经食道超声心动图检查结果,选择了宽度和长度均为6毫米的Amplatzer 血管塞II(AVPII)。AVPII与输送导管相连,被装入鞘中。将AVPII的第一个(远端)圆盘打开进入主动脉管腔,然后缩回整个鞘和AVPII,将装置的中央部分留在PDA的壶腹部,最后通过进一步缩回鞘和将最后一个(近端)圆盘放入肺动脉管腔来固定装置。通过轻轻推拉输送导丝来确定AVPII的安全位置。
经食道超声心动图验证了装置的位置、左右肺动脉的通畅性和分流完全闭塞(下图)。术前每隔90分钟注射一次头孢氨苄,手术过程持续了50分钟。麻醉后恢复顺利。
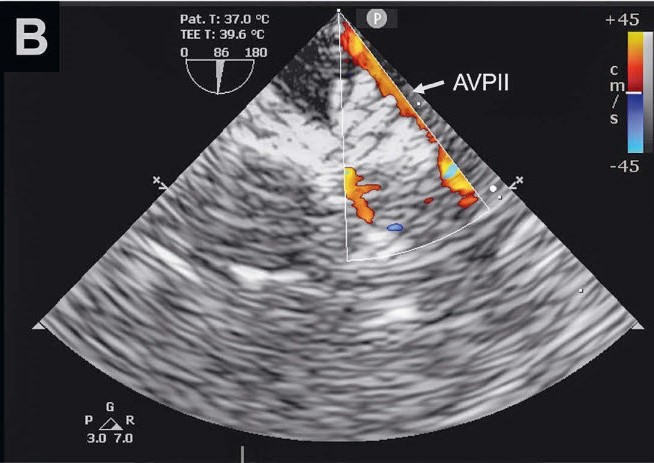
↑ 在PDA壶腹部植入AVPII后,未发现残余分流进入肺动脉(PA)。
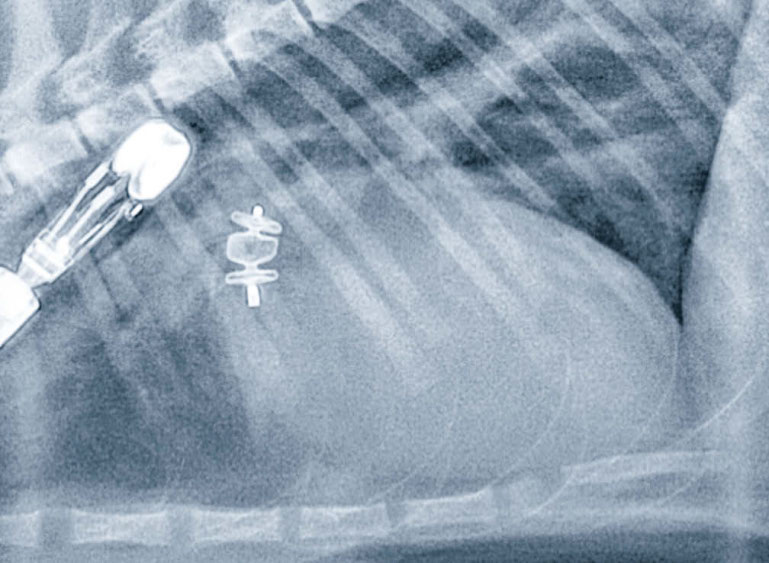
↑ 植入AVPII(具有三层圆盘结构的不透光结构),以经静脉封堵PDA后拍摄的胸部侧后方放射影像。心脏轮廓背面的不透光管状结构是一个经食道探头。
04 预后
成功安装装置后,心脏听诊未发现心脏杂音。在介入治疗几小时后进行的超声心动图检查中,左心看起来已经变小(左心房最大直径13毫米),AVPII位置正确,彩色多普勒也没有发现分流(下图CD)。
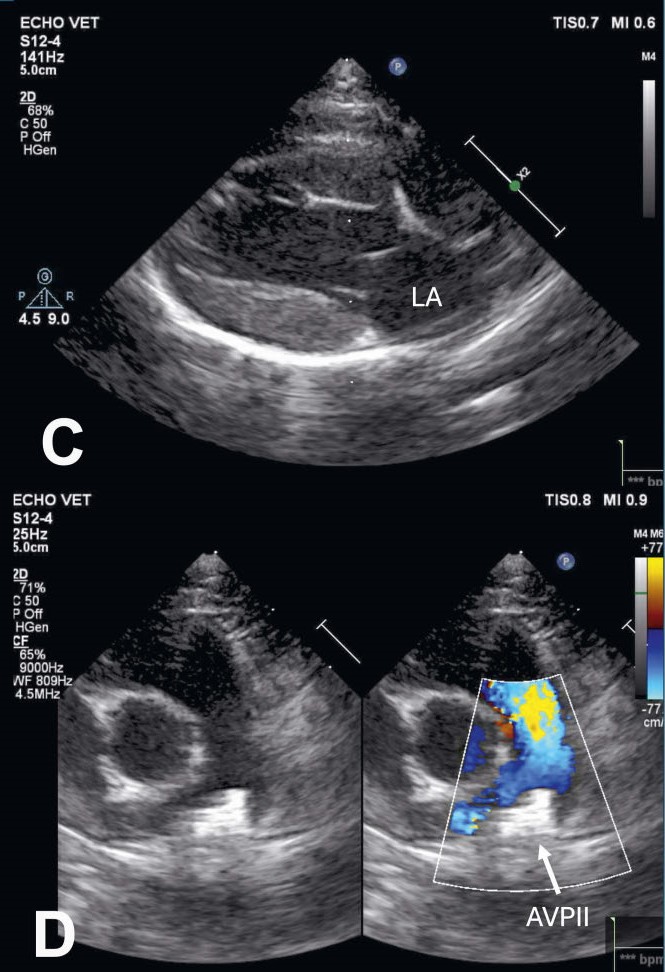
↑(C)在PDA闭塞几小时后,左心房(LA)的直径已明显缩小(13毫米),体积主观上趋于正常。(D)使用AVPII闭塞后PDA的二维灰度和彩色多普勒综合图像。AVPII出现在PDA壶腹部(箭头),没有发现PDA存在残余分流。
05 讨论
动脉导管未闭(Patent ductus arteriosus,PDA)是狗最常见的心血管畸形之一,但在猫中发病率较低(每1000只猫中有0.2例)[5,7]。它源于胎儿时期连接主动脉和肺动脉的动脉导管未闭合,使得血流在胎儿发育期间绕过未扩张的肺部。出生几小时后,PDA应完全闭塞。如果壶腹部壁内缺乏收缩成分,则可能发生不完全闭塞。
由于主动脉和肺动脉之间存在压力差,这通常会导致左向右分流。根据PDA的大小,可能会出现左侧容量超负荷,继而出现充血性心力衰竭(即肺水肿)和过早死亡[1,5]。在极少数情况下,PDA可能会导致肺血管压力严重升高,分流方向可能逆转(右向左分流)[1,3]。如果是左向右分流,通常可以通过闭塞PDA延长寿命[5]。
手术结扎PDA一直是治疗猫这种异常的最常用方法。但据报道,侧胸切开术和导管结扎术的死亡率相对较高(死亡率从2.9%到80%不等)[1,4]。此外,对猫来说,这种类型的手术有很大的并发症风险,包括出血、喉麻痹、变声、吞咽困难、发烧和术后乳糜积液[4]。
此外,手术时间也较长(在13只猫中,中位手术时间为115分钟)[4] ,而本报告中的猫进行微创闭塞所需的时间为50分钟。除手术结扎外,儿科和兽医心脏病学领域还开发了几种微创技术,尝试在血管内闭塞PDA[6,7]。
与需要进行开胸手术的外科手术相比,血管内栓塞可通过经皮穿刺血管,或通过皮肤小切口和直接血管显像和导管检查进行。经动脉方法需要导管插入股动脉、腹主动脉和降主动脉,直至PDA。在此位置,可使用栓塞线圈或Amplatzer犬血管闭塞器闭塞血管。然后根据最小导管直径的两倍决定线圈或Amplatzer闭塞器的适当尺寸[6,7]。
这种方法相对简单,因为只需对动脉而非心脏进行导管操作即可到达PDA。选择动脉入路的局限性在于动脉的尺寸,猫的动脉通常非常小,无法将适当尺寸的导入器推进动脉进行手术。
另一方面,股静脉通常比较大,即使是较小的猫也能比较容易地推进4 Fr插鞘。因此,这种方法需要逆行静脉系统,穿过后腔静脉、右心房和心室,直到肺动脉,最终到达PDA[2,6]。只有在经食道超声心动图的引导下,才能安全地确定PDA的正确大小,以选择最合适的AVPII并进行准确的部署。
选择用于展开的AVPII的直径应约为PDA壶腹部最大直径的1.3-1.5倍。对于小体型患者,如猫和玩具犬(体重小于4-5千克),由于体型较小,必须使用专门的儿科探头,以避免食管损伤和撕裂[8,9]。
总之,这是首例使用AVPII经静脉途径对猫进行PDA闭塞的病例。为确保安全和成功的介入治疗,需要高水平的技术技能和高端设备,如透视和儿科经食道探头。假设所有这些因素都得到满足,那么任何体型的患者都有可能成为微创闭塞PDA的候选者。与手术相比,这种方法缩短了住院时间,减少了疼痛,降低了并发症的风险,如血管撕裂或不慎结扎肺动脉分支[4,7]。
文献来源:Baron Toaldo M, Schreiber N. Occlusion of a patent ductus arteriosus using an Amplatzer vascular plug II in a kitten. Schweiz Arch Tierheilkd. 2025 Apr;167(4):240-244.
参考文献
1. Bascunn A, Thieman Mankin KM, Saunders AB, Bright JM, Scharf V, Singh A, O’Sullivan L, Brisson B, Estrada AH, Tou SP, Ruoff C: Patent ductus arteriosus in cats (Felis catus): 50 cases (2000–2015). J. Vet. Cardiol. 2017; 19: 35–43.
2. Belachsen O, Sargent J, Koffas H, Schneider M, Wagner T: The use of Amplatzer vascular plug II in 32 consecutive dogs for transvenous occlusion of patent ductus arteriosus. J. Vet. Cardiol. 2022; 41: 88–98.
3. Greet V, Bode EF, Dukes-McEwan J, Oliveira P, Connolly DJ, Sargent J: Clinical features and outcome of dogs and cats with bidirectional and continuous right-to-left shunting patent ductus arteriosus. J. Vet. Intern. Med. 2021; 35: 780–788.
4. Hutton JE, Steffey MA, Runge JJ, McClaran JK, Silverman SJ, Kass PH. Surgical and nonsurgical management of patent ductus arteriosus in cats: 28 cases (1991–2012). J. Am. Vet. Med. Assoc. 2015; 247: 278–285.
5. López-Alvarez J: Patent ductus arteriosus in cats. Vet. Rec. 2016; 179: 15–16.
6. Markovic LE, Hiremath G, Scansen BA, Kellihan HB, Calkins C, Coleman AE, Tjostheim SS, Tainter B, Hodges KM, Cahill E, Carter M, Kim DW: Comparative transcatheter occlusion of patent ductus arteriosus: multicenter collaborative study across pediatric and veterinary cardiology centers. J. Vet. Cardiol. 2024; 30: 56–72.
7. Scansen BA: Cardiac Interventions in Small Animals: Areas of Uncertainty. Vet. Clin. North Am. Small Anim. Pract. 2018; 48: 797–817.
8. Schrope DP: Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J. Vet. Cardiol. 2015; 17: 192–202.
9. Stoner CH, Saunders AB: Evaluation of two probes for transesophageal echocardiography in small dogs: imaging capabilities, image quality, and usability. J. Vet. Cardiol. 2023; 45: 41–49.
10. Stoner CH, Saunders AB, Heseltine JC, Cook AK, Lidbury JA: Prospective evaluation of complications associated with transesophageal echocardiography in dogs with congenital heart disease. J. Vet. Intern. Med. 2022; 36: 406–416.