
| 一般情况 | |
 | 品种:短毛猫 |
| 年龄:12岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:甲状旁腺瘤 | |
01 主诉及病史
因颈部肿块和高钙血症接受评估,经细胞学诊断怀疑是癌。
1年前接受过光动力疗法治疗鼻腔鳞状细胞癌,出现了部分疗效,后续使用锶90贴近疗法治疗后出现了较好疗效。2年前还在另一家机构接受过放射性碘131治疗以治疗甲亢。
高钙血症首次出现在接受锶90贴近疗法治疗时,总钙3.1 mmol/L [2-2.7],离子钙1.5 mmol/L [1.12-1.43],以及2个月后的随访中。由于缺乏高钙血症的临床表现,主人拒绝了进一步的检查。
其他病史包括亚临床肥厚型心肌病和IRIS II期慢性肾病。医生建议限制磷酸盐饮食,但主人没有遵守。发病时存在多尿和多饮,但其他情况良好。
02 检查
体重4千克,体况评分5/9。颈部左侧腹侧有一个3.2-3.5厘米大小的坚实、可移动、无痛感肿块。有III/VI级右侧心脏杂音。其他临床检查均正常。
全血细胞计数无异常。血生化显示氮质血症:尿素(14.7 mmol/L [5.4-10.7])、肌酐(179 μmol/L [56-153])、总钙(3.5 mmol/L [2-2.7])和离子钙(1.84 mmol/L [1.12-1.4])升高。磷酸盐浓度正常偏低(1.1 mmol/L [0.9-2.1])。
使用化学发光法测定的血清甲状旁腺激素(PTH)升高(73 pg/mL [0-20]);PTH相关肽(PTHrp)和总甲状腺素浓度正常。未检测促甲状腺激素。
通过膀胱穿刺获得的尿液为等比重尿(1.016),尿蛋白-肌酐比值正常。多普勒超声间接测量的收缩压正常。
胸片显示慢性支气管气道疾病和慢性愈合的肋骨骨折,没有转移性疾病的证据。MRI显示颈椎中腹部水平有一个大的异质性T2W/STIR高强化和T1W轻度高强化的肿块(下图)。左侧甲状旁腺不可见。右侧甲状腺和甲状旁腺均正常。目前还不清楚肿块的来源是甲状腺还是甲状旁腺,但PTH的升高让人怀疑是后者。
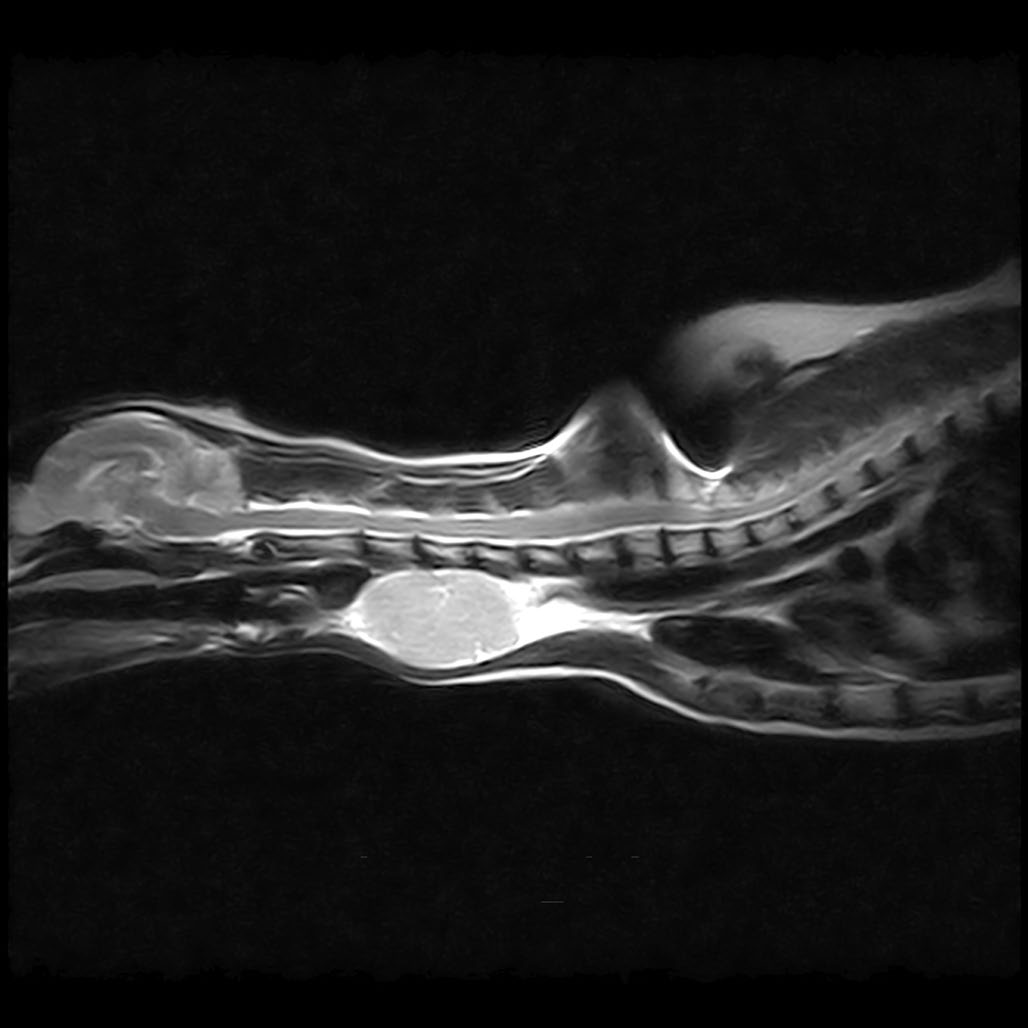
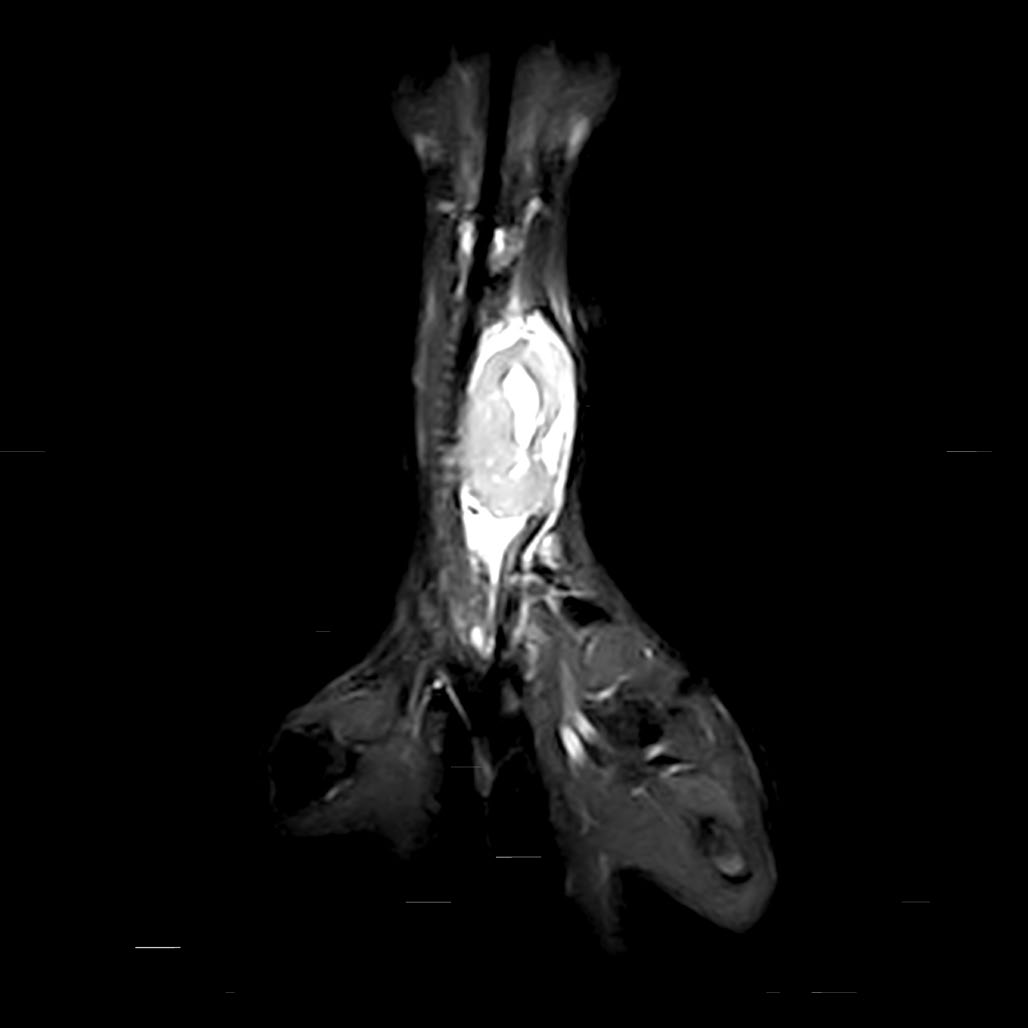
↑ 颈部MRI成像T2W矢状切面和STIR背侧切面。在颈椎中腹部水平,有一个巨大的异质性T2W/STIR高密度肿块。肿块位于气管外侧,气管向右侧移位。肿块中心有多灶性的T2W明显高强化区域。
根据影像学检查结果和对甲状旁腺肿瘤的怀疑,主人选择了手术切除。
03 治疗
切除了颈部肿物,组织病理学提示为上皮性或神经内分泌性肿瘤,可能起源于甲状腺或甲状旁腺(下图)。从组织学角度看,手术切缘无肿瘤,肿块与周围组织分界清楚,无局部浸润迹象。
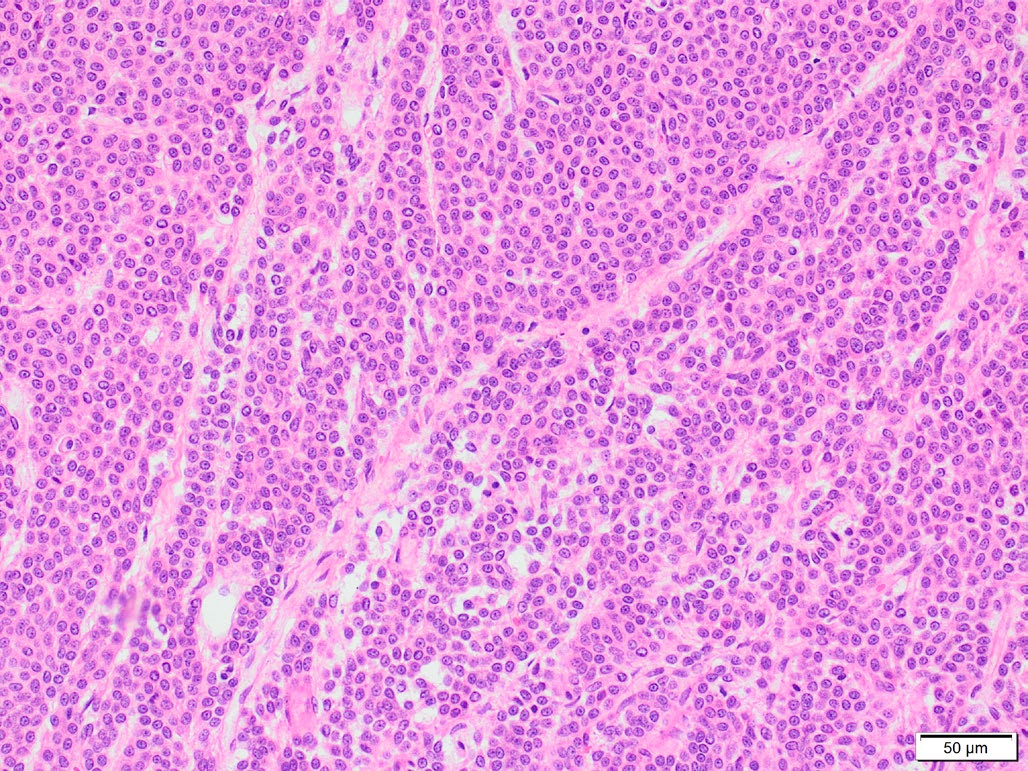
↑ 颈部肿块H&E染色。肿瘤细胞形成苍白的小梁和少量腺泡。每十个高倍镜视野(2.37平方毫米)有4个有丝分裂。
对组织切片进行了细胞角蛋白、CD18、波形蛋白、S100、甲状腺球蛋白、嗜铬粒蛋白A和突触素的免疫组化染色。切片显示S100和波形蛋白呈均匀阳性反应,80%的肿瘤细胞的嗜铬粒蛋白A呈中等或强阳性反应(下图)。增殖细胞群中有少量细胞表现出细胞角蛋白阳性免疫反应。甲状腺球蛋白、CD18和突触素阴性。该病例最符合具有非典型分子标记表达的甲状旁腺来源肿瘤。
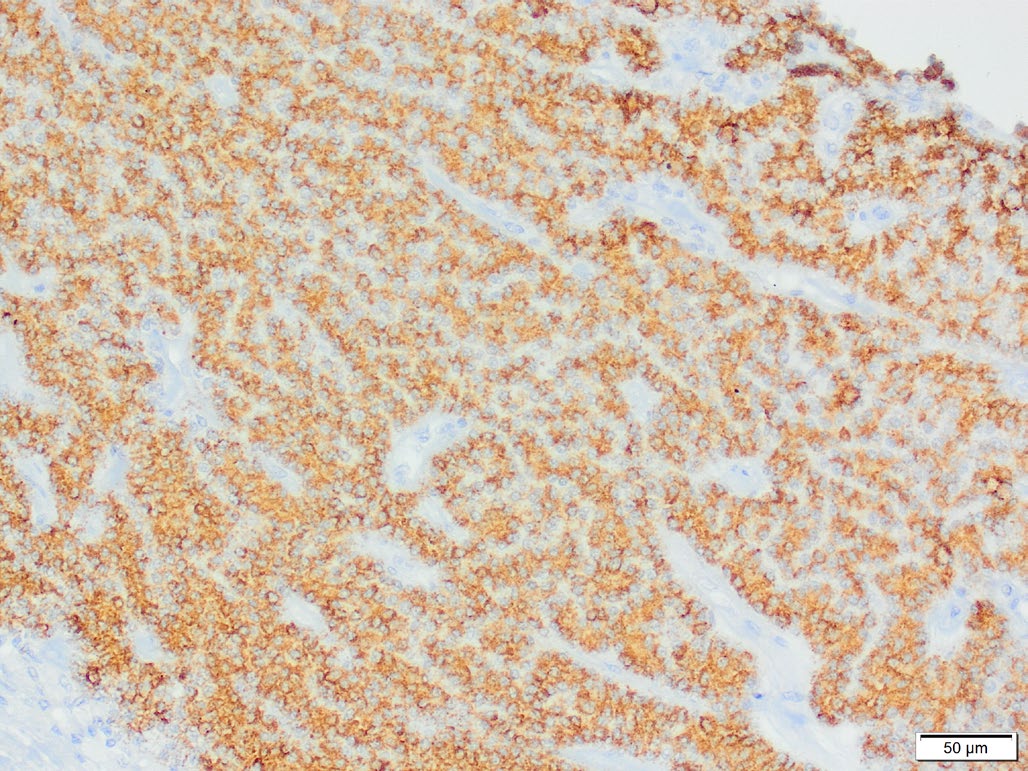
↑ 颈部肿块嗜铬粒蛋白A免疫组化。肿瘤细胞对嗜铬粒蛋白A呈颗粒状胞质免疫反应。肿瘤细胞形成细小的小梁和少量腺泡。
04 预后
术后住院4天。术后开始使用0.05 mL阿法骨化醇(2 μg/mL溶液),每天两次,以防止出现低钙血症。离子钙从术前的1.8 mmol/L降至出院时的1.35 mmol/L [1.12-1.4]。
每两周进行一次复查,离子钙测量结果详见下表。阿法骨化醇剂量逐渐减少,并在术后152天血钙正常时停用。
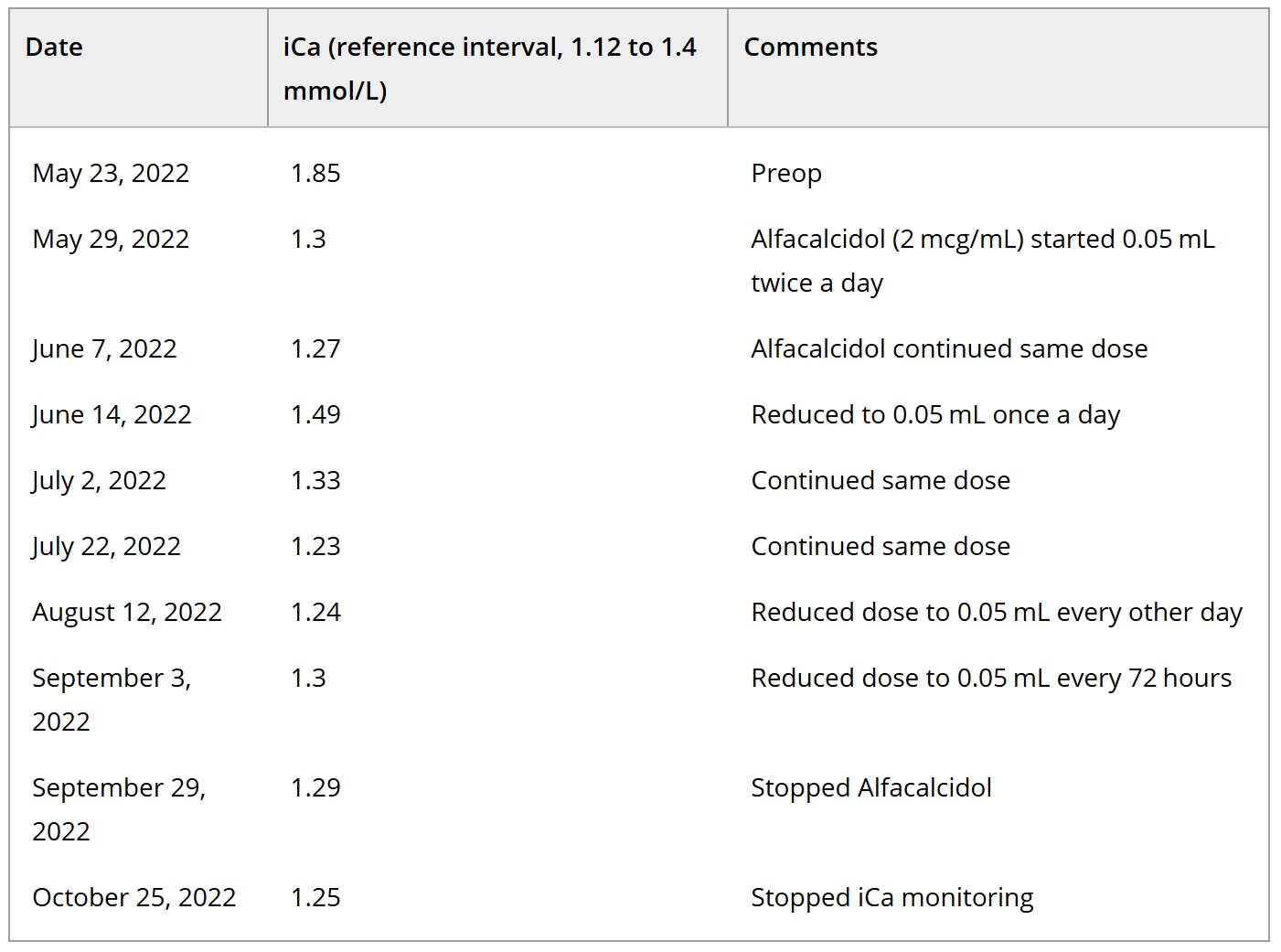
术后17个月,无高钙血症或氮质血症,符合IRIS II期慢性肾脏病的标准。
05 讨论
高钙血症的定义是血清钙水平升高超过给定参考值的上限[1]。甲状旁腺激素(PTH)是参与调节血钙的主要激素,由甲状旁腺合成。猫有两个甲状旁腺,分别与甲状腺的腺叶相连。PTH通过骨骼、肾脏和胃肠道这三个主要靶器官增加血清钙浓度并降低血清磷酸盐浓度[2]。
特发性高钙血症被认为是高钙血症猫最常见的诊断[2]。在最近的两项研究中,只有2.1%[3]和5.6%[4]的高钙血症猫被诊断为原发性甲状旁腺功能亢进(pHPT)。大多数患有pHPT的猫都是单发甲状旁腺腺瘤[5,6]。被诊断为原发性甲状旁腺增生、癌或囊腺瘤的病例较少[6-8]。
自1975年发表第一份病例报告以来,已有多项研究记录了外部辐射与人类pHPT之间的联系[9]。放射性碘(RAI)在人类医学中用于治疗良性和恶性甲状腺肿瘤,以及Graves病等增生性疾病[10],剂量方案因治疗的具体病症而异。
RAI被认为是引发pHPT的危险因素,但RAI暴露与pHPT发病之间的剂量相关性尚未确定。推测虽然甲状旁腺不会浓缩碘,但由于其靠近甲状腺,可能会导致甲状旁腺暴露于辐射,进而引发pHPT[9]。
猫pHPT在文献中鲜有报道[4,6,8]。患病猫通常是中老年猫,临床症状包括呕吐、多尿、多饮、体重减轻和可触及的颈部肿块[5]。
面对高钙血症,正常或较高的PTH浓度被认为是pHPT的诊断依据[11]。本病例的离子钙升高、磷酸盐浓度正常、PTH升高、PTHrp正常。甲状旁腺区域存在肿块、影像学检查结果以及手术切除肿块后高钙血症的完全缓解进一步支持了这一诊断。
总之,尽管有大型队列研究对接受RAI治疗的猫的预后进行了评估[12],但之前并没有关于pHPT的报道。本报告首次记录了一只猫在接受RAI治疗后出现甲状旁腺功能亢进的情况。
文献来源:Ruane E, Odatzoglou P, Wong H, Hayes A. Primary hyperparathyroidism in a domestic shorthair cat following I131 radioiodine therapy. J Small Anim Pract. 2025 Apr 1.
参考文献
[1] Endres, D.B. (2012) Investigation of hypercalcemia. Clinical Biochemistry, Bone and Calcium, 45, 954–963.
[2] Finch, N.C. (2016) Hypercalcaemia in cats: the complexities of calcium regulation and associated clinical challenges. Journal of Feline Medicine and Surgery, 18, 387–399.
[3] Broughton, S.E., O’Neill, D.G., Syme, H.M. & Geddes, R.F. (2023) Ionized hypercalcemia in 238 cats from a referral hospital population (2009-2019). Journal of Veterinary Internal Medicine, 37, 80–91.
[4] Savary, K.C.M., Price, G.S. & Vaden, S.L. (2000) Hypercalcemia in cats: a retrospective study of 71 cases (1991–1997). Journal of Veterinary Internal Medicine, 14, 184–189.
[5] Parker, V.J., Gilor, C. & Chew, D.J. (2015) Feline hyperparathyroidism: pathophysiology, diagnosis and treatment of primary and secondary disease. Journal of Feline Medicine and Surgery, 17, 427–439.
[6] Singh, A., Giuffrida, M.A., Thomson, C.B., Baum, J., Kramek, B., Liptak, J.M. et al. (2019) Perioperative characteristics, histological diagnosis, and outcome in cats undergoing surgical treatment of primary hyperparathyroidism. Veterinary Surgery, 48, 367–374.
[7] Bonczynski, J. (2007) Primary hyperparathyroidism in dogs and cats. Clinical Techniques in Small Animal Practice, 22, 70–74.
[8] Kallet, A.J., Richter, K.P., Feldman, E.C. & Brum, D.E. (1991) Primary hyperparathyroidism in cats: seven cases (1984-1989). Journal of the American Veterinary Medical Association, 199, 1767–1771.
[9] Bobanga, I., Jin, J., Wilhelm, S., Sarode, A., Alvarado, C.E., ElSherif, A. et al. (2023) Primary hyperparathyroidism after radioactive iodine therapy: is it a distinct clinical entity? The American Journal of Surgery, 225, 180–183.
[10] Law, R.H., Quan, D.L., Stefan, A.J., Peterson, E.L. & Singer, M.C. (2021) Hyperparathyroidism subsequent to radioactive iodine therapy for Graves’ disease. Head & Neck, 43, 2994–3000.
[11] Barber, P.J. (2004) Disorders of the parathyroid glands. Journal of Feline Medicine and Surgery, 6, 259–269.
[12] Slater, M.R., Geller, S. & Rogers, K. (2001) Long-term health and predictors of survival for hyperthyroid cats treated with iodine 131. Journal of Veterinary Internal Medicine, 15, 47–51.