
| 一般情况 | |
 | 品种:长毛猫 |
| 年龄:1岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:孢子丝菌病 | |
01 主诉及病史
2024年6月,因多处皮肤溃疡就诊。
平时喜欢户外活动,但没有出过远门。
02 检查
体重3.9千克。神情淡漠、中度脱水、粘膜苍白、多处皮下溃疡,其中一些溃疡伴有坏死和化脓(下图C-G)。触诊患处时疼痛,还发现鼻息肉,鼻中隔明显变形,并伴有鼻出血(下图A-B)。
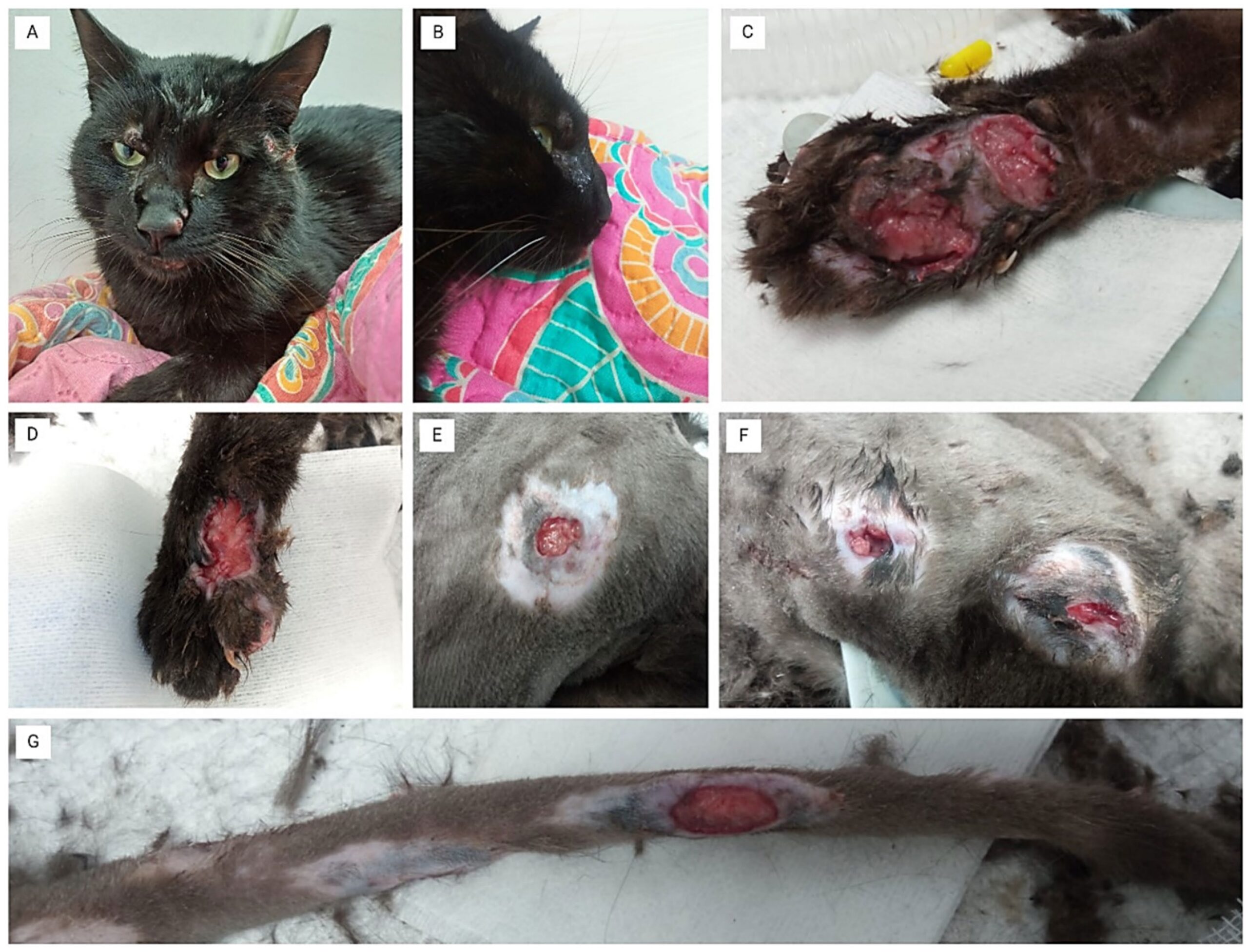
↑ (A)面部出现病变,鼻中隔变形。(B)鼻平面变形。(C)左前肢严重溃疡,大面积组织坏死和深度溃疡。(D)右前肢溃疡性病变,有坏死和化脓迹象。(E)胸部圆形溃疡病灶,中央坏死,周围发炎。(F)胸部外侧多处溃疡,每个病变周围都有坏死和炎症迹象。(G)尾部的溃疡,显示出严重的组织损伤和暴露的坏死组织。
血液检查显示中度贫血、血小板减少、低血糖、肝酶升高、低钾血症和低氯血症,这些都是与全身炎症有关的代谢恶化指标。
腹部超声发现了双侧肾病、急性炎症性肝病、胆囊炎伴胆汁淤积和胰腺炎,提示存在全身感染过程。逆转录病毒感染结果为阴性。
对伤口和鼻腔分泌物进行了细胞学检查,样本中发现了大量真菌(下图A)。组织活检取样后发现,有强烈的弥漫性白细胞浸润和广泛的凝聚性炎症灶,炎症灶由中心的中性粒细胞组成,周围有淋巴细胞和巨噬细胞。病变部位含有大量细胞碎片,代表凋亡或坏死成分。在巨噬细胞的细胞质内和细胞外都发现了大量PAS阳性的真菌样结构,其形态提示为孢子丝菌,大小不规则,有轻微的多形性(下图B-D)。
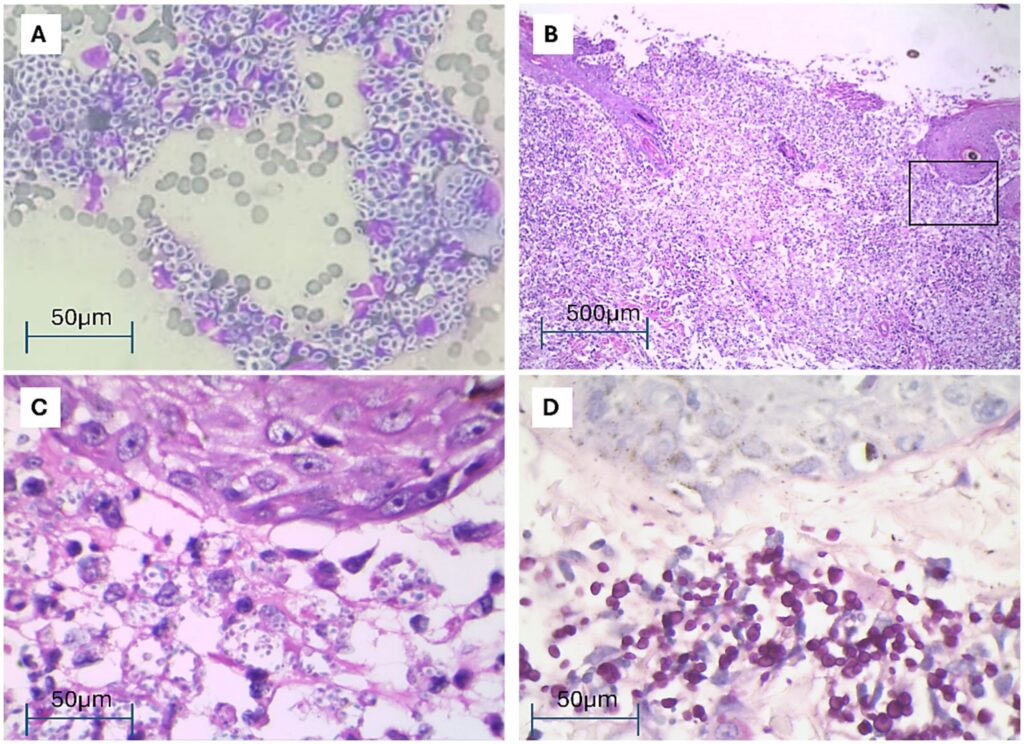
↑ (A)细胞学涂片显示混合性炎症浸润,主要由巨噬细胞组成,伴有大量游离或吞噬的真菌样生物。(B)皮肤活检显示真皮和皮下出现溃疡、强烈的化脓性炎症浸润。(C)B的一个区域放大(黑色矩形),显示上皮下有大量游离或被吞噬的真菌样生物。(D)上皮下显示大量PAS阳性的游离或吞噬的真菌样生物。
将组织样本磨碎后进行真菌培养,10天后可以从形态上鉴定出孢子丝菌(下图A)。从菌落培养液中提取DNA,基因测序后证实该菌落为巴西孢子丝菌(Sporothrix brasiliensis)。药敏检测发现唑类药物对受试菌株表现出良好的活性,但氟康唑除外。两性霉素B(AMB)不敏感,与培养皿扩散技术观察到的结果一致(下图B)。
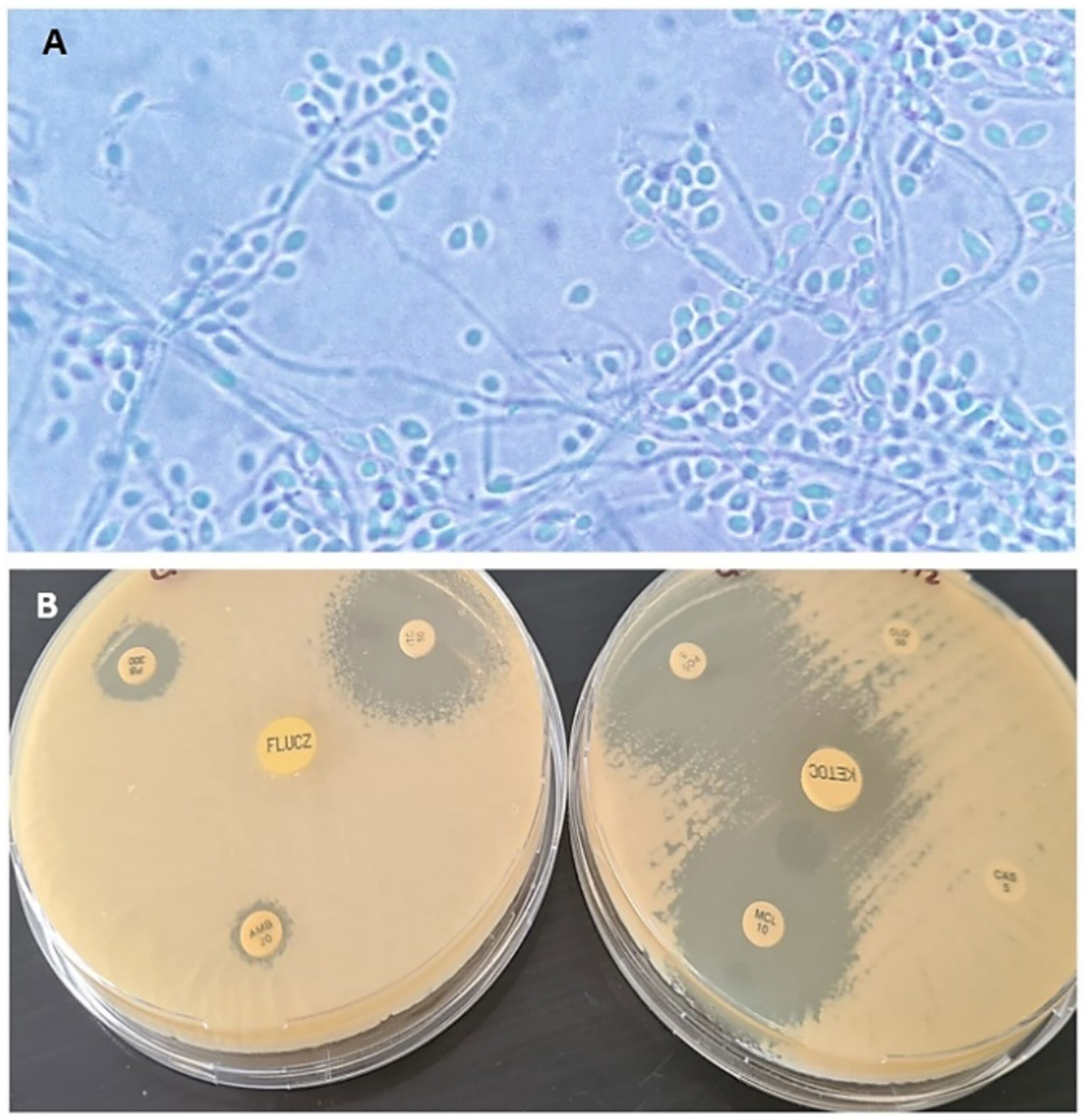
↑ (A)100倍放大镜下观察:细的菌丝、有隔透明菌丝、无梗分生孢子和交感分生孢子排列在细的菌丝的末端。(B)通过培养皿扩散法检测对抗真菌药物的敏感性,显示咪康唑、伊曲康唑、酮康唑和泊沙康唑的抑菌环大于18毫米。
03 治疗
患者被转移到隔离区,医护人员执行了严格的管理规程并配备了个人防护设备。
以乳酸林格氏液作为首选晶体液进行输液。开始使用伊曲康唑(100 mg/只,PO,SID)加碘化钾(2.5 mg/kg,PO)进行经验性治疗。还加入了氨苄西林-舒巴坦(20 mg/kg,IV,TID)。
为了控制疼痛和炎症,使用了曲马多(4 mg/kg,IV,QID)、普瑞巴林(2 mg/kg,IV,BID)、甲咪唑(20 mg/kg,IV,TID)和美洛昔康(0.1 mg/kg,IM,SID)。为了保护胃肠道粘膜,加入了奥美拉唑(1 mg/kg,IV,BID),并持续治疗7天。
04 预后
经过8天的抗真菌治疗后,病情继续恶化,出现了意识减退、体温过低和面部脓肿疼痛等症状。为了优化镇痛效果,开始持续输注氯胺酮,首先静脉注射0.5 mg/kg的负荷剂量,然后以10 μg/kg/分的速度输注。用美沙酮代替曲马多,每6小时静脉注射0.3 mg/kg,从而有效控制了疼痛。
随访超声显示全身病变进展,肾病和肝病恶化,并伴有溃疡性胃炎。实验室检测结果显示病情明显恶化:贫血加重、白细胞升高、严重的代谢性酸中毒,表明患者正在出现全身性失代偿。谷丙转氨酶和谷草转氨酶升高,反映出肝脏炎症正在发展。血小板持续减少,并检测到低蛋白血症,表明蛋白质流失。
第20天,除了化脓灶外,还出现了低血压(SBP<100 mmHg),持续高乳酸血症(>4 mmol/L)。尽管进行了强化治疗,包括两次输血、持续输注去甲肾上腺素和多巴酚丁胺等血管活性药物以稳定血压,以及持续输注氢化可的松以控制炎症和疑似肾上腺功能不全,但临床症状仍不稳定。
第21天,出现了不可逆的全身衰竭,表现为持续的血流动力学不稳定和全身炎症反应综合征,并伴有进行性多系统恶化。此时患者被安乐死。
05 讨论
孢子丝菌病(Sporotrichosis)是由孢子丝菌引起的一种真菌病,主要侵袭人和动物的皮下组织[1,2]。在全球范围内,申克氏孢子丝菌(Sporothrix schenckii)是这种真菌病的主要病原体[3]。
然而,近几十年来,在南美洲,巴西孢子丝菌(Sporothrix brasiliensis)已成为对猫毒性最强的致病菌[4-6]。该物种曾引起大规模流行病暴发,广泛分布于巴西,尽管其地理分布已扩展到阿根廷、巴拉圭和智利等其他国家[7,8]。
这种真菌主要通过家猫的咬伤或抓伤传播,家猫被认为是该疾病的主要储藏者和传播媒介[9,10]。这种传播途径导致孢子丝菌病被归类为人畜共患病,生活在基础设施条件较差地区的受感染猫的家庭,及兽医和助手都是感染这种疾病的高危人群[11]。
感染这种真菌的猫会出现结节性和溃疡性皮损,主要分布在头部、四肢和尾部。在严重的病例中,感染会通过淋巴系统扩散,并影响内脏器官,从而使临床治疗复杂化,预后不佳[9,12]。
孢子丝菌病的诊断需要结合临床表现、细胞学、组织病理学和真菌培养,同时需要使用分子技术进行菌种鉴定。由于在南美洲,猫的疫情爆发可能与巴西孢子虫有关,因此物种鉴定非常重要[13]。
2022年,智利首次在马加兰内斯地区的猫孢子丝菌病病例中检测到巴西孢子丝菌,标志着该国孢子丝菌病流行病学的一个转折点[14]。一年后,瓦尔帕莱索报告了一例人类淋巴皮肤孢子丝菌病病例[15],随后圣地亚哥也报告了首例记录在案的狗孢子丝菌病病例[16]。最近又有病例报告,表明该病原体在巴西迅速向北传播[17]。
作者在智利圣多明各-瓦尔帕莱索地区报告了一例由巴西孢子丝菌引起的猫严重孢子丝菌病。该真菌在同一地区的另一个地方的猫(17只)和一名女性(15只)身上已有记录。
该患者表现出快速的全身传播,伴有代谢和血液学改变,这一临床表现突显了巴西孢子丝菌的高毒力,可导致严重的全身性疾病。既往研究表明,与逆转录病毒阴性猫相比,患有孢子丝菌病并感染逆转录病毒的猫表现出免疫改变和更严重的临床表现[25]。在人类患者中也观察到了这一点[12,26]。
本报告强调了关于孢子丝菌病相关风险的公众教育,并促进负责任的动物管理实践,以防止这种传染源进一步传播。
文献来源:Cartes A, Thomson P, González C, Dos Santos AR, Díaz R, Puyol J, López J. Case report: Severe ulcerative dermatitis leading to sepsis in a cat with sporotrichosis bySporothrix brasiliensis. Front Vet Sci. 2025 Apr 28;12:1573924.
参考文献
1.Rodrigues AM, Della Terra PP, Gremião ID, Pereira SA, Orofino-Costa R, de Camargo ZP. The threat of emerging and re-emerging pathogenic Sporothrix species. Mycopathologia. (2020) 185:813–42.
2.Bombassaro A, Spruijtenburg B, Medeiros F, Favoreto J, de Souza LB, Ballardin LB, et al. Genotyping and antifungal susceptibility testing of Sporothrix brasiliensis isolates from southern Brazil. Mycoses. (2023) 66:585–93.
3.De Carolis E, Posteraro B, Sanguinetti M. Old and new insights into Sporothrix schenckii Complex biology and identification. Pathogens. (2022) 11:297.
4.Gremião ID, Menezes RC, Schubach TM, Figueiredo AB, Cavalcanti MC, Pereira SA. Feline sporotrichosis: epidemiological and clinical aspects. Med Mycol. (2015) 53:15–21.
5.Gremião IDF, Miranda LHM, Reis EG, Rodrigues AM, Pereira SA. Zoonotic epidemic of sporotrichosis: cat to human transmission. PLoS Pathog. (2017) 13:e1006077.
6.Hernández-Castro R, Pinto-Almazán R, Arenas R, Sánchez-Cárdenas CD, Espinosa-Hernández VM, Sierra-Maeda KY, et al. Epidemiology of clinical sporotrichosis in the Americas in the last ten years. J Fungi. (2022) 8:588. 7.Rodrigues AM, Gonçalves SS, de Carvalho JA, Borba-Santos LP, Rozental S, Camargo ZPD. Current progress on epidemiology, diagnosis, and treatment of sporotrichosis and their future trends. J Fungi. (2022) 8:776.
8.Xavier MO, Poester VR, Trápaga MR, Stevens DA. Sporothrix brasiliensis: epidemiology, therapy, and recent developments. J Fungi. (2023) 9:921.
9.Gremião IDF, da Silva M, da Rocha E, Montenegro H, Carneiro AJB, Xavier MO, et al. Guideline for the management of feline sporotrichosis caused by Sporothrix brasiliensis and literature revision. Braz J Microbiol. (2021) 52:107–24.
10.Alvarez CM, Oliveira MME, Pires RH. Sporotrichosis: a review of a neglected disease in the last 50 years in Brazil. Microorganisms. (2022) 10:2152.
11.Arenas R, Sánchez-Cardenas CD, Ramirez-Hobak L, Ruíz Arriaga LF, Vega Memije ME. Sporotrichosis: from KOH to molecular biology. J Fungi. (2018) 4:62.
12.Lloret A, Hartmann K, Pennisi MG, Ferrer L, Addie D, Belák S, et al. Sporotrichosis in cats: ABCD guidelines on prevention and management. J Feline Med Surg. (2013) 15:619–23.
13.Della Terra PP, Gonsales FF, de Carvalho JA, Hagen F, Kano R, Bonifaz A, et al. Development and evaluation of a multiplex qPCR assay for rapid diagnostics of emerging sporotrichosis. Transbound Emerg Dis. (2022) 69:e704–16.
14.Thomson P, González C, Blank O, Ramírez V, Río C, Santibáñez S, et al. Sporotrichosis outbreak due to Sporothrix brasiliensis in domestic cats in Magallanes, Chile: a one-health-approach study. J Fungi. (2023) 9:226.
15.Cruz-Choappa R, Vieille P, Noguera M, Villablanca S, Tognarelli J. First isolation of Sporothrix brasiliensis in a human case of sporotrichosis in Chile. An emerging and worrisome fungus. Rev Chil Infectol. (2023) 40:569–72.
16.Dumont A, González C, Rivera B, Mercy I, Thomson P. Challenging frontiers: canine sporotrichosis due to Sporothrix brasiliensis, first case in Chile. Med Mycol Case Rep. (2024) 44:100632.
17.Escobar MC, Cifuentes Ramos F, Alvarez Rojas CA. Sporothrix brasiliensis in cats from Santiago. Chile Med Mycol Case Rep. (2024) 43:100624.
18.White TJ, Bruns T, Lee S, Taylor J. Amplification, and direct sequencing of fungal ribosomal RNA genes for phylogenetics In: Innis MA, Gelfand DH, Sninsky JJ, White TJ, editors. PCR protocols. New York: Academic Press; (1990). 315–322.
19.Clinical and Laboratory Standards Institute . CLSI reference method for broth dilution antifungal susceptibility testing of filamentous fungi. Wayne, PA: Clinical and Laboratory Standards Institute; (2008). 52 p.
20.Troia R, Buzzurra F, Ciuffoli E, Mascalzoni G, Foglia A, Magagnoli I, et al. Classification of septic shock phenotypes based on the presence of hypotension and hyperlactatemia in cats. Front Vet Sci. (2021) 8:692528.
21.Cortellini S, DeClue AE, Giunti M, Goggs R, Hopper K, Menard JM, et al. Defining sepsis in small animals. J Vet Emerg Crit Care (San Antonio). (2024) 34:97–109.
22.Escaffi MJ, Benedetto AB, Podlipnik CS, Díaz JMC, Misad SC. Esporotricosis cutánea: revisión a propósito de un caso contraído en Chile. Rev chil dermatol. (2010) 26:154–8.
23.Cruz R, Vieille P, Oschilewski D. Aislamiento ambiental de Sporothrix globosa en relación a un caso de esporotricosis linfo-cutánea. Rev Chil Infectol. (2012) 29:401–5.
24.Cruz Choappa RM, Vieille Oyarzo PI, Carvajal Silva LC. Isolation of Sporothrix pallida complex in clinical and environmental samples from Chile. Rev Argent Microbiol. (2014) 46:311–4.
25.de Miranda LHM, Meli M, Conceição-Silva F, Novacco M, Menezes RC, Pereira SA, et al. Co-infection with feline retrovirus is related to changes in immunological parameters of cats with sporotrichosis. PLoS One. (2018) 13:e0207644.
26.Queiroz-Telles F, Buccheri R, Benard G. Sporotrichosis in immunocompromised hosts. J Fungi. (2019) 5:8.