
| 一般情况 | |
 | 品种:美国短毛猫 |
| 年龄:10岁 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:脓胸 | |
01 主诉及病史
因呼吸困难、厌食、嗜睡和体重减轻就诊。
曾被诊断患有慢性肾病(IRIS 2期),每3天在家接受一次皮下注射液治疗。主要生活在室内,但偶尔也会在有人看护的情况下外出。核心疫苗接种情况良好,并定期接受寄生虫防治。
02 检查
呼吸困难,直肠温度37.4°C,血压74 mmHg。听诊有4/6级心脏杂音。血液检查结果:轻度贫血、严重白细胞增多伴淋巴细胞增多、高球蛋白血症、白蛋白/球蛋白比值降低,血清中N端前B型钠尿肽(NT-proBNP)和猫血清淀粉样蛋白A(fSAA)浓度显著升高。
胸部X线检查显示,两侧胸腔内的软组织不透明度增加,遮住了心脏和膈肌轮廓。这些结果符合双侧胸腔积液和肺不张(下图)。
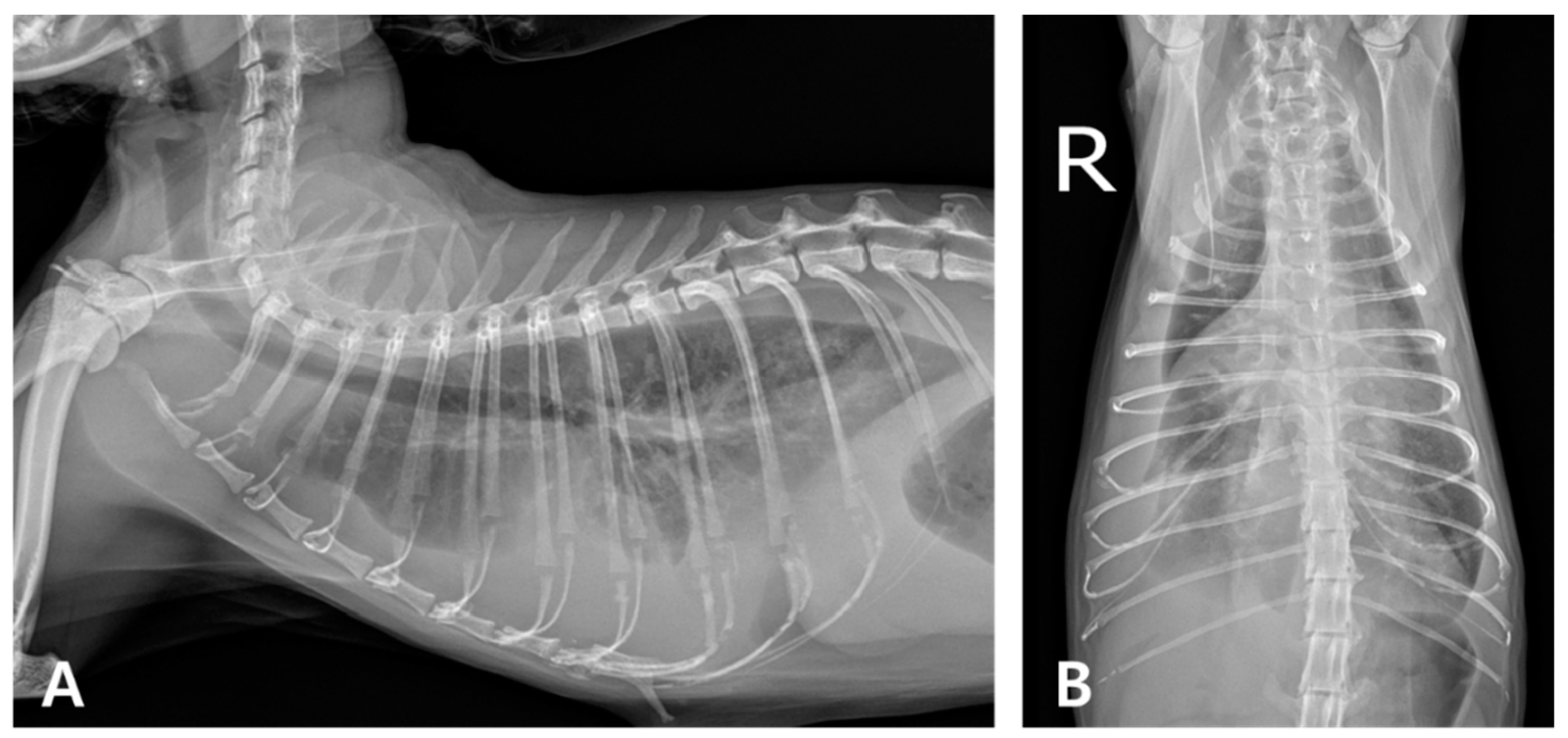
↑ (A)右侧切面和(B)腹背切面。胸腔内可见明显的双侧软组织不透明,遮住了心脏和膈肌边缘。双侧肺叶从胸壁缩回,符合双侧胸腔积液和肺不张。
胸腔穿刺术取出100毫升混浊、淡黄色的粘稠液体(下图A),蛋白质浓度为4.6 mg/dL,总核细胞数为239.93 K/μL。细胞学检查发现主要是变性的中性粒细胞、巨噬细胞和淋巴细胞,以及疑似杆状细菌(下图B)。怀疑是化脓性渗出物,胸腔积液被送去进行细菌培养和PCR检测。
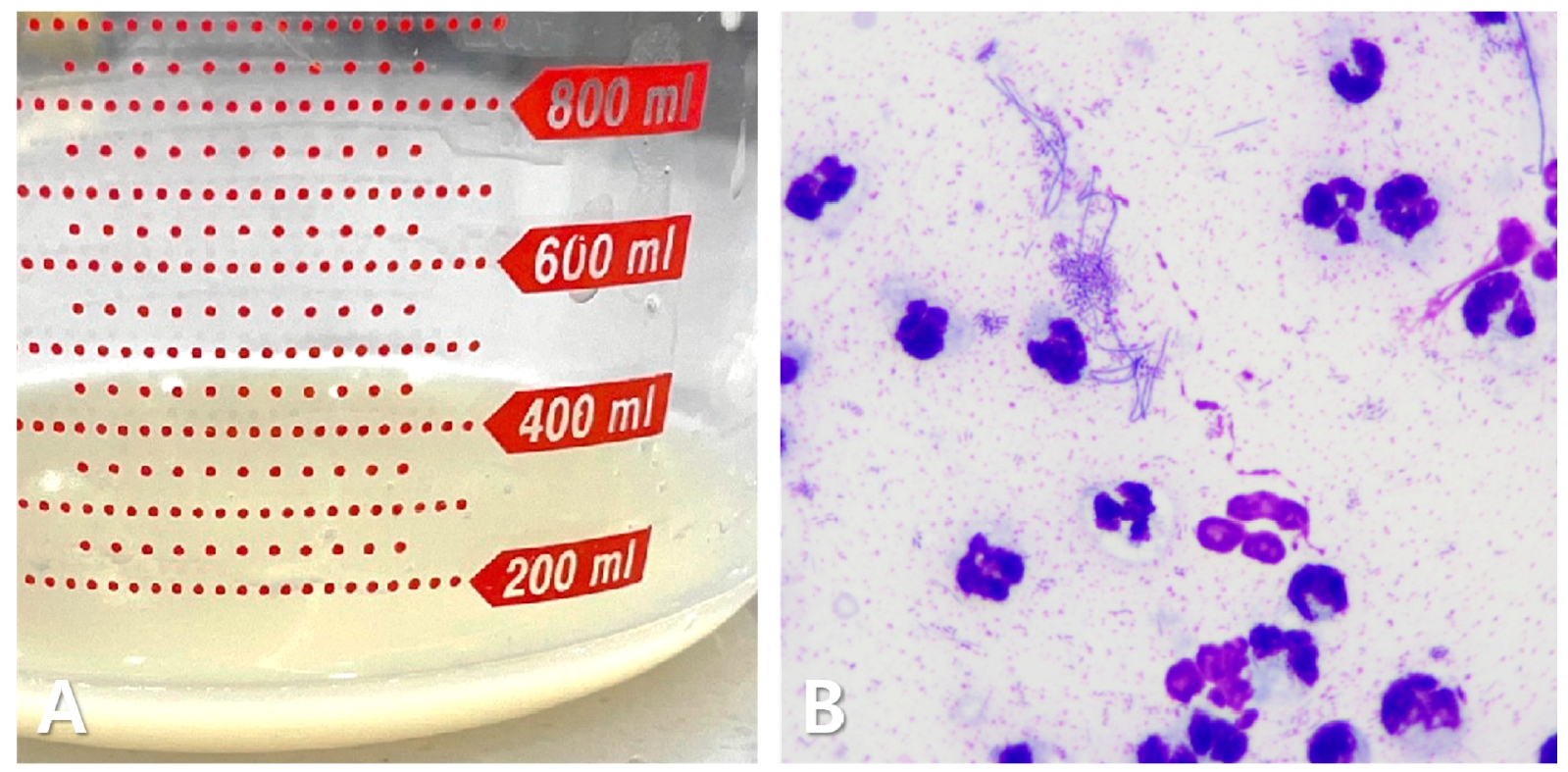
↑ 胸腔积液为浑浊、淡黄色、粘稠的液体(A)。细胞学检查显示以变性中性粒细胞为主,还有一些巨噬细胞和淋巴细胞,存在大量杆状细菌结构(B)。
由于心脏杂音和NT-proBNP升高,患者接受了超声心动图检查,结果显示左心室壁增厚(最大7. 7 mm)、乳头肌肥大、二尖瓣收缩期前移、左室流出道轻度动态阻塞、二尖瓣和三尖瓣反流、左房严重增大(LA:Ao比值2.15)和轻度心包积液,与肥厚型心肌病一致(下图)。
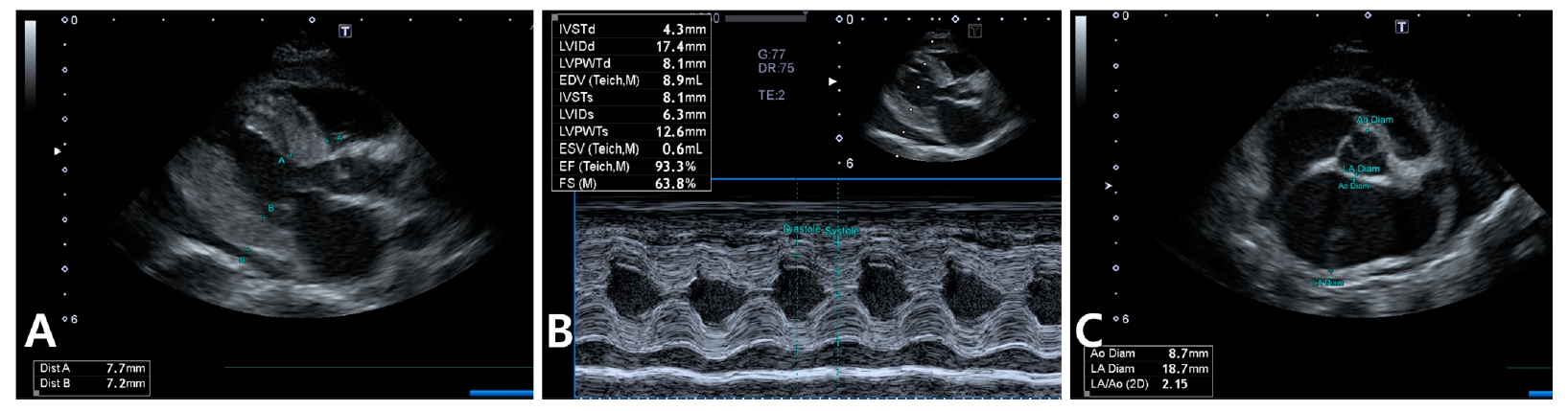
↑ 超声心动图显示,舒张期左心室壁最大厚度约为7.7毫米,同时伴有乳头肌肥大、二尖瓣收缩期前移和轻度心包积液(A)。M模式也观察到类似的结果(B)。严重的左心房增大也很明显(C)。
03 治疗
由于病情严重,而且预计细菌培养结果会延迟,因此开始了经验性广谱抗生素治疗。选择了阿莫西林-克拉维酸、甲硝唑和马波沙星的组合,以抑制需氧和厌氧病原体。
治疗包括静脉注射阿莫西林-克拉维酸(12.5 mg/kg,q12h)、甲硝唑(10 mg/kg,q12h)、马波沙星(2.75 mg/kg,q24h)和奥美拉唑(1 mg/kg,q12h)。口服药物包括匹莫本丹(0.25 mg/kg,q12h)、呋塞米(1 mg/kg,q12h)和氯吡格雷(18.75 mg/猫,q24h)。
虽然放置了胸腔造口管,但2天后因气胸而拔除。此时,胸腔积液的细菌培养和PCR结果出来了。分离出的鲁斯梭杆菌(Fusobacterium russii)是一种革兰氏阴性厌氧杆菌,对三种经验性选择的抗生素均敏感。基于这些发现,最初的抗菌治疗方案未作修改。猫传染性腹膜炎的PCR检测结果呈阴性。
04 预后
治疗8天后,临床症状有所改善,胸腔积液减少(下图),血液学指标也有所改善。出院时给开了口服抗生素。
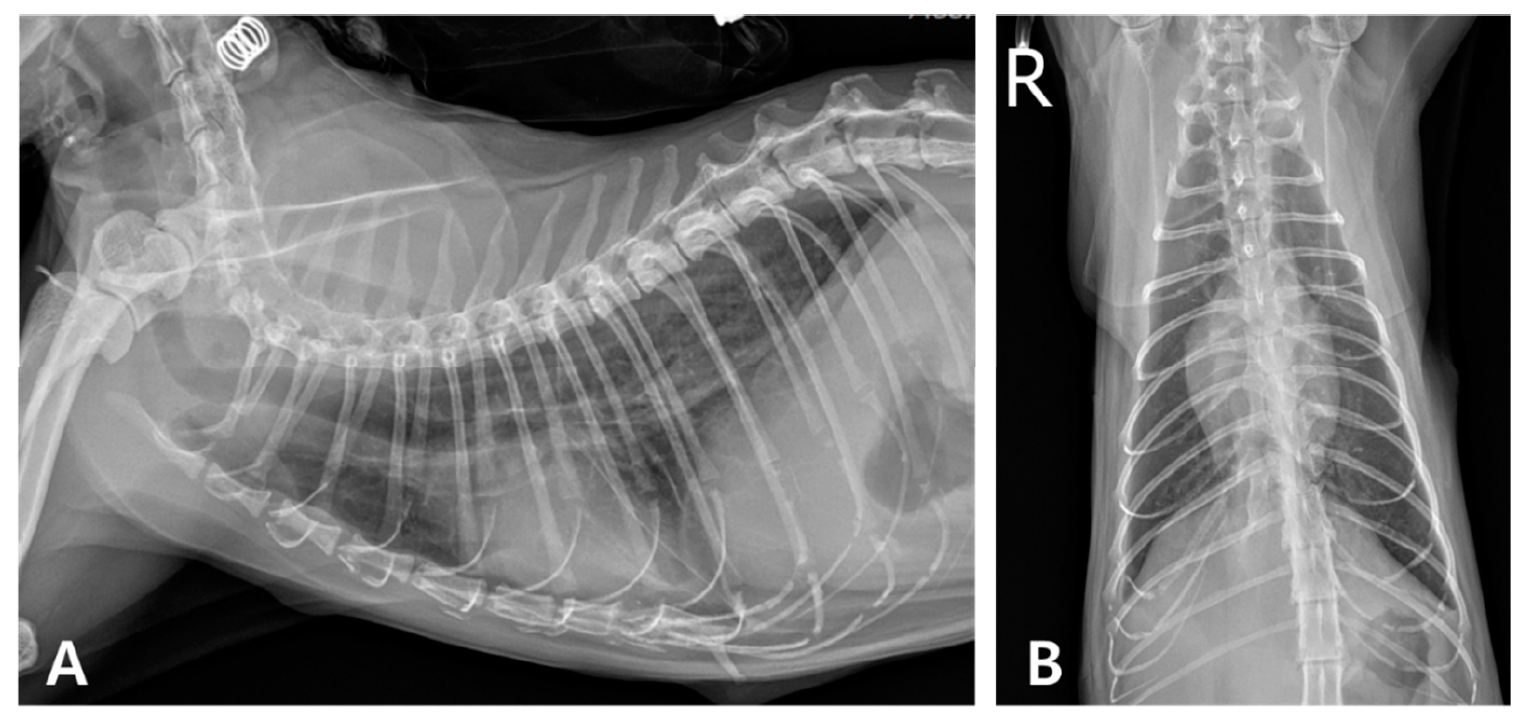
↑ 第8天的胸部X光片。(A)右侧和(B)腹背切面显示胸腔内胸水明显减少。
2周后,由于严重腹泻,抗生素被停用;但心脏药物仍继续使用。
2个月后,因咳嗽、呼吸困难和嗜睡等症状恶化而被转回我院。体温41.1°C,白细胞增多,fSAA升高,轻度贫血。影像学显示右肺尾叶和后纵隔的不透明度增加(下图)。CT发现后腔静脉和食管周围有无定形病变,伴有液体衰减、气体阴影和边缘强化,符合后纵隔食管旁积脓(下图)。胸腔积液细胞学检查显示有中性粒细胞和巨噬细胞,但无传染性病原体,积液蛋白4.3 mg/dL,有核细胞总数为21.25 K/µL。
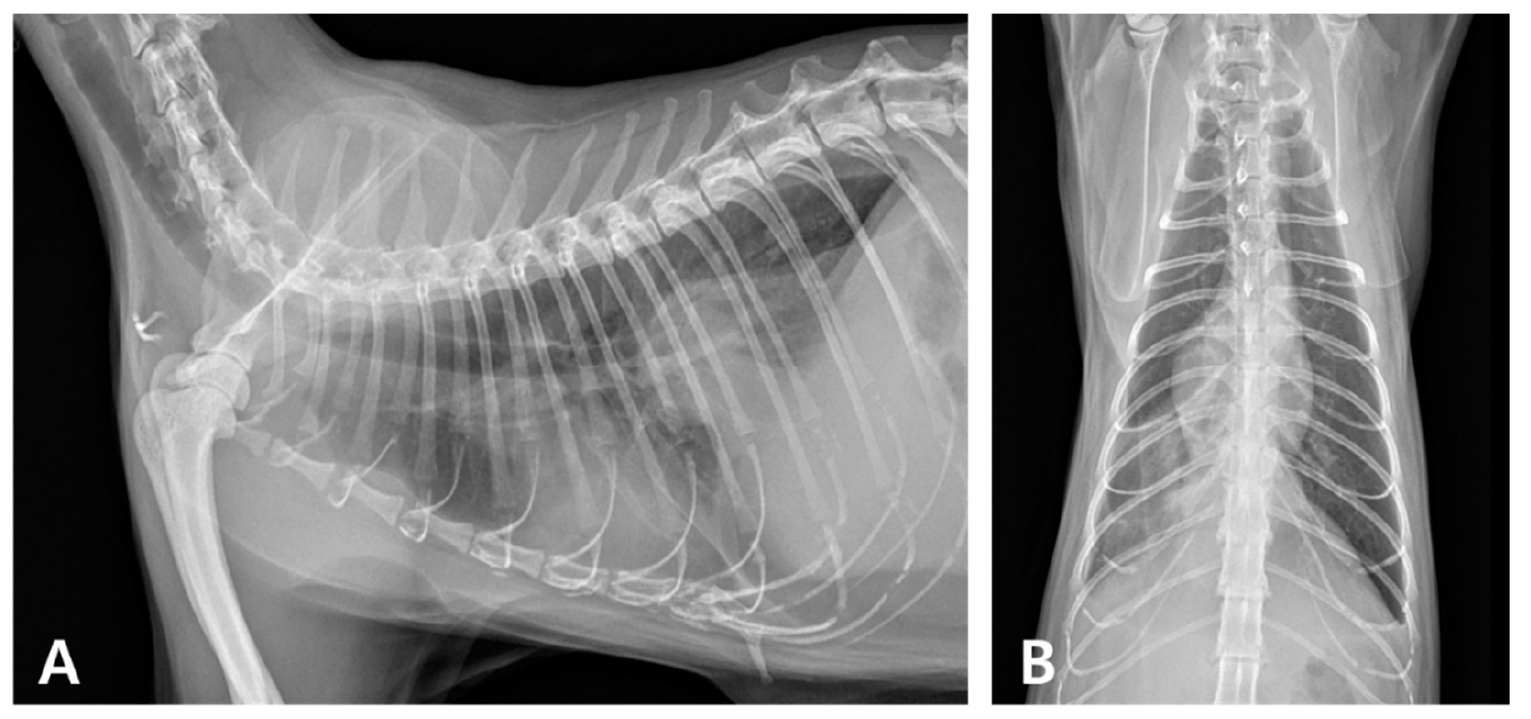
↑ 复发时的胸片。(A)右侧和(B)腹背切面显示右肺尾叶不透明增加,后纵隔有软组织不透明结构。
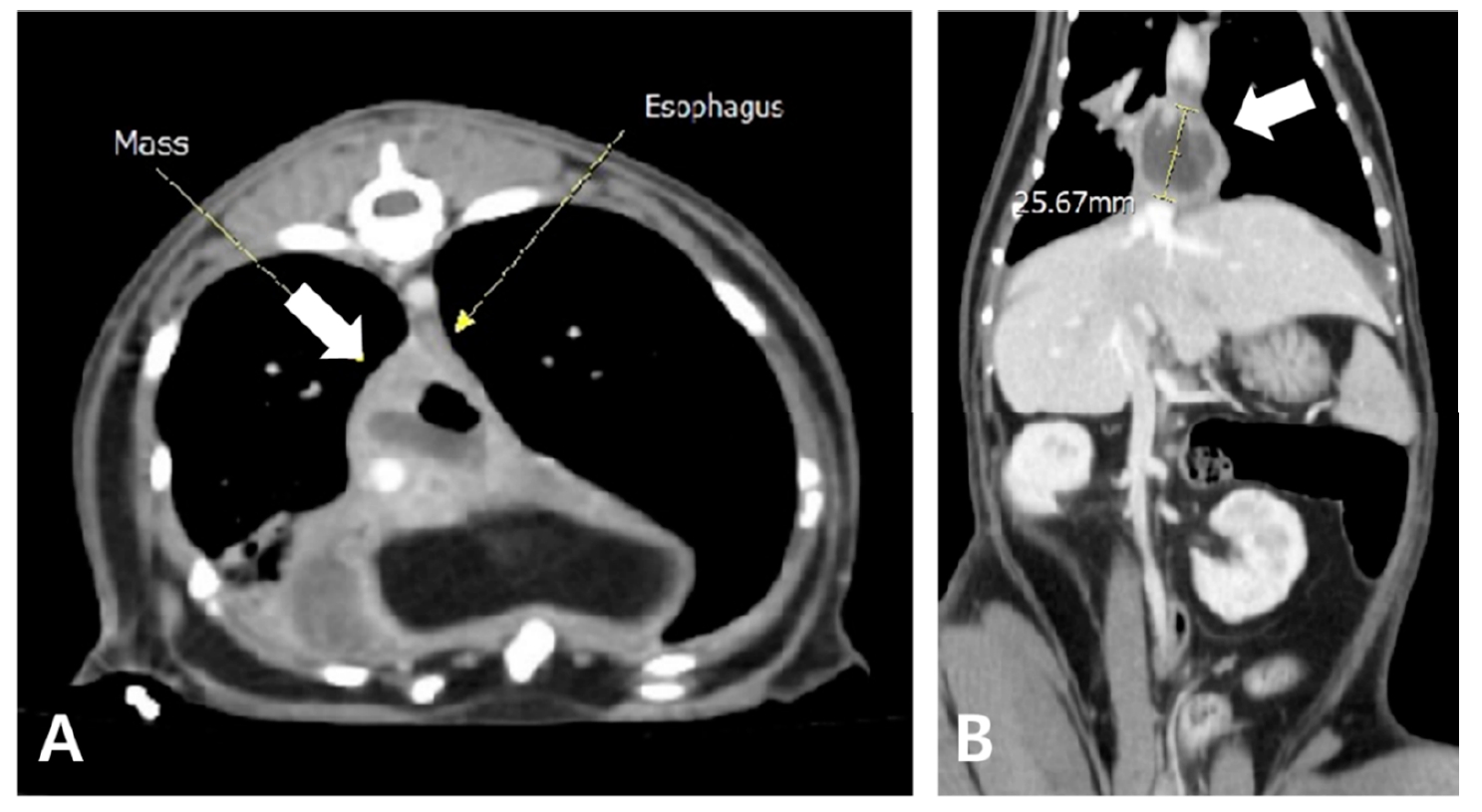
↑ 对比后CT结果的轴位(A)和冠状位(B)。后纵隔附近观察到一个无定形肿块样结构(白色箭头),位于食管右侧和背侧。病变呈液性衰减,有气体不透明区域,使用造影剂后呈边缘强化。
由于最初的抗生素在复发期间效果不佳,因此改用美罗培南(10 mg/kg,IV,q8h)取代甲硝唑,以提高厌氧菌的覆盖率并解决潜在的耐药性问题。最初使用美洛昔康(0.2 mg/kg,SC,q24h)和米氮平(1.88 mg/猫,PO,q48h)分别用于退烧和刺激食欲,但随着症状改善,这两种药物均被停用。超声心动图显示心脏异常已消除,因此停用心脏药物。
临床症状恶化促使患者在复发12天后接受了开胸手术。通过第7-8肋间的切口进行了右肋间胸廓切开术。切开皮肤和皮下组织后,通过背侧牵拉保留了背阔肌。分离腹锯齿肌和肋间肌,以便进入胸腔,并使用Finochietto牵开器保持手术区域暴露。
胸廓切开术发现了严重的纤维素性胸膜炎、膈肌增厚和明显的炎症变化(下图A)。右肺中叶和尾叶呈深色,相互粘连,膈肌和肺叶之间也有粘连。对这些粘连进行了手术剥离和清创(下图B)。获得的胸腔积液轻度浑浊,呈黄色,粘度较低(下图C)。排出胸腔积气后,放置了双侧12 Fr胸腔造口管以进行长期管理(下图D)。闭合胸壁,将胸肌尽可能恢复到原来位置,常规缝合。
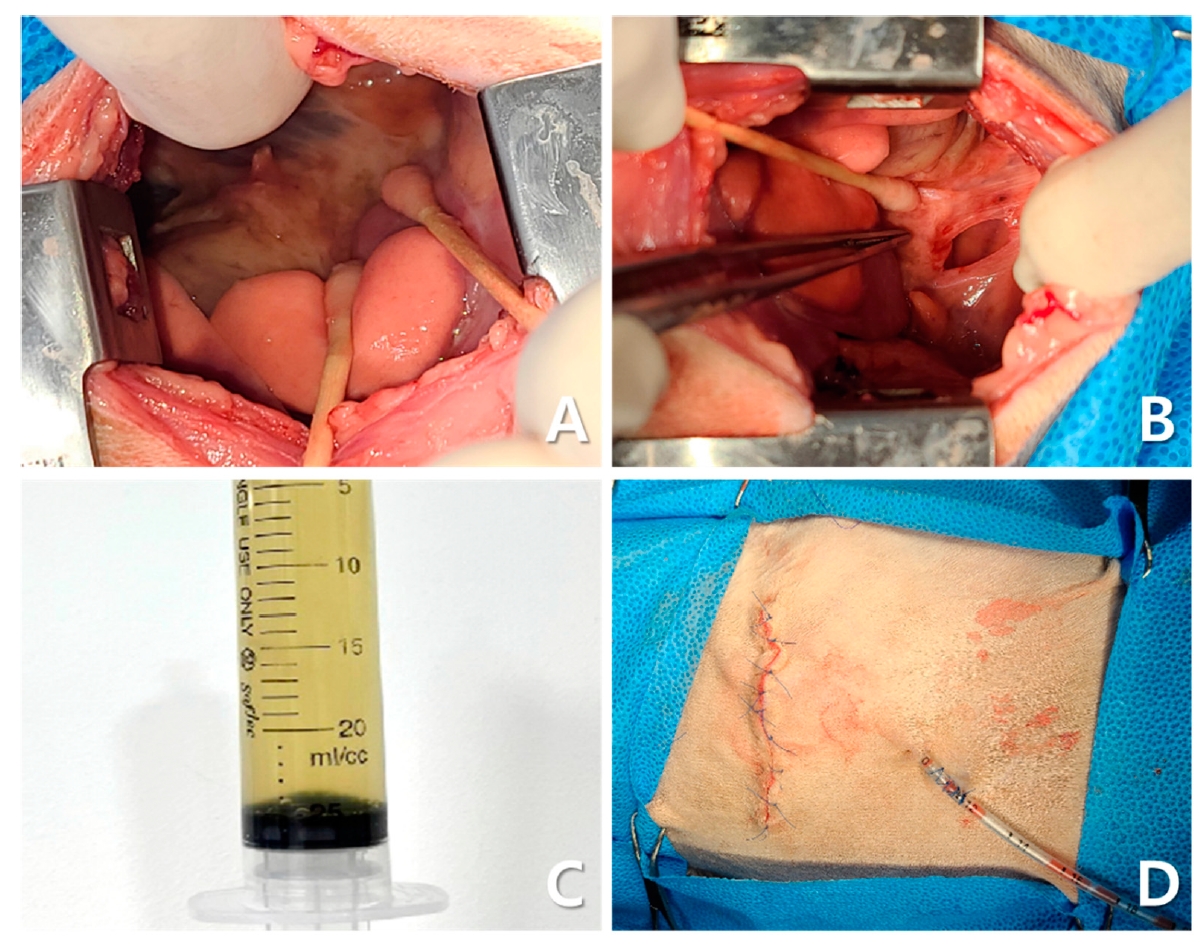
↑ 开胸手术的术中发现。右胸腔内可见弥漫性纤维素性胸膜炎、膈肌增厚和炎症改变(A)。由于右肺中叶和尾叶与膈肌粘连,进行了清创和分离手术(B)。观察到黄色胸腔积液,粘度较低,浑浊度略有增加(C)。置入双侧胸腔造口管进行长期引流(D)。
组织病理学检查显示有明显的炎症浸润,包括中性粒细胞、巨噬细胞、淋巴细胞、浆细胞、纤维蛋白和细胞碎片,但没有肿瘤或活动性感染。
术后进行了为期2周的胸腔引流和灌洗。使用双侧胸腔造口管尽可能多地清除胸腔积液后,灌注并抽吸20毫升肝素化哈特曼溶液(稀释至10 IU/mL),加热至体温。然后再灌注和抽吸20毫升温哈特曼溶液。每天进行两次。
手术干预后,临床症状迅速改善。术中采集的样本的细菌培养结果发现了非病原菌伯克霍尔德菌(Burkholderia cenocepacia),抗生素治疗没有改变。由于未发现感染性病原体,因此停用了其他抗生素,只使用美罗培南(10 mg/kg,SC,q12h)。由于胸腔积液中持续存在大量中性粒细胞,开了泼尼松龙(0.5 mg/kg,PO,q12h)和己酮可可碱(10 mg/kg,PO,q12h),并继续每天胸腔灌洗。
出院后第29天,病情明显好转,拔掉了胸腔造口管,停止了灌洗。在接下来的一个月里,所有药物都逐渐减少。
6个月后,没有再出现脓胸或心脏异常,体重也没有增加。但右肺尾叶的不透明程度持续增加(下图)。
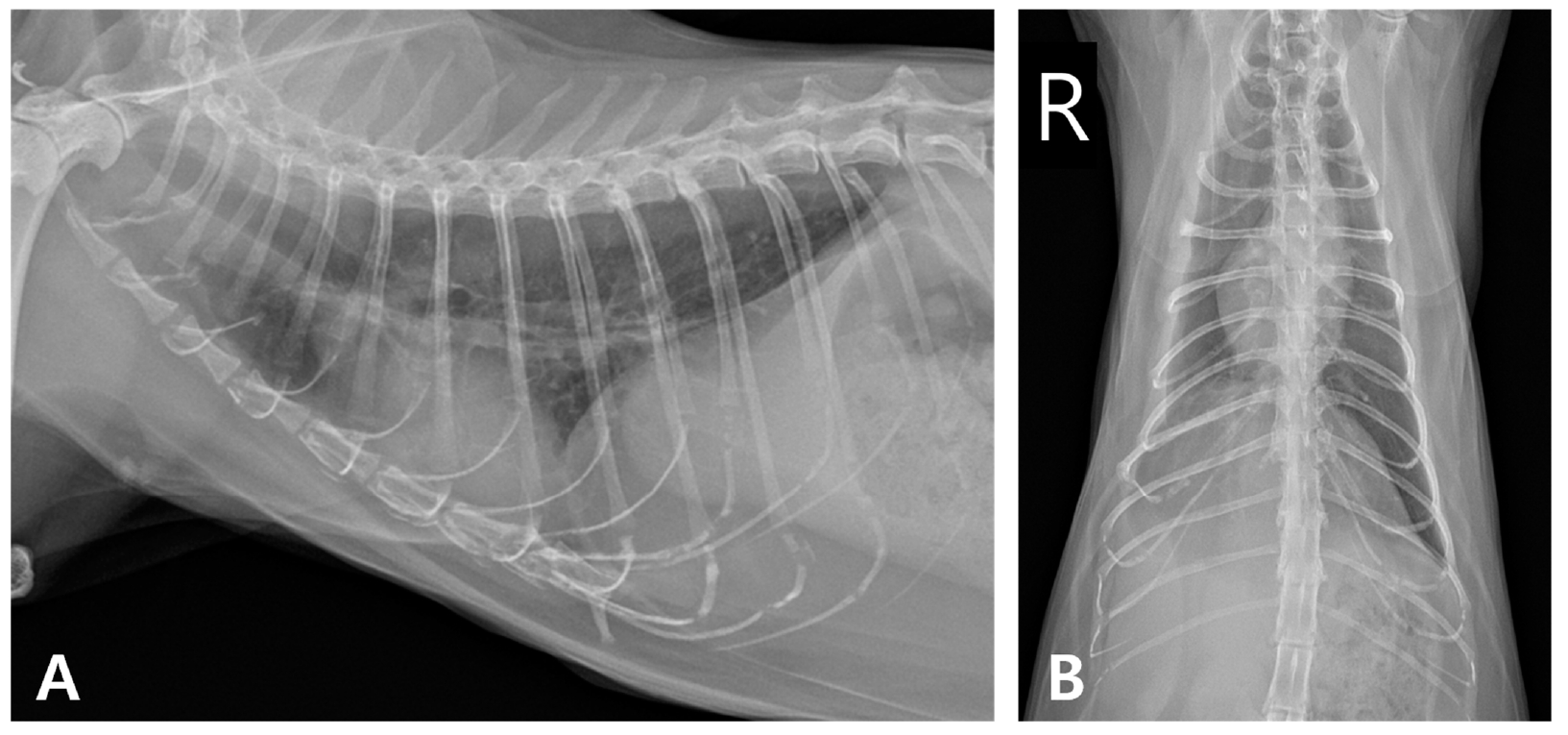
↑ 停药后的胸片监测。(A)右侧位和(B)腹背切面。
05 讨论
猫脓胸或胸腔积液是一种因感染而在胸腔内积聚化脓性渗出物的疾病[1-3]。通常情况下,被诊断出患有脓胸的猫年龄在4-6岁之间,年龄相对较小,但所有年龄段的猫都有可能患上这种疾病。没有关于猫的品种或性别倾向的报道[1,2]。
在猫的病例中,约70-90%的脓胸为双侧性,可表现为急性或慢性。常见的临床症状包括急性或慢性呼吸困难、呼吸急促、精神萎靡、嗜睡、苍白和厌食。体格检查显示肺部听诊减弱、腹部呼吸用力增加和呼吸模式矛盾。最初发病时通常会出现脓毒症,严重的败血症可能会出现体温过低和心动过缓[1,4-6]。
猫脓胸的主要病因是细菌感染,80%以上的病例涉及混合厌氧菌感染。已知的胸腔感染源包括胸壁穿刺伤口(如咬伤)、异物、食道裂伤和气管旁扩散[2-5]。然而,在大多数病例中(35-67%),确定感染病因仍是一项挑战[2,7,8]。
目前,兽医学中没有标准化的脓胸治疗方案。一般来说,治疗包括胸腔引流和解决潜在的感染原因,如果需要,可以考虑手术干预。然而,兽医和人类医学缺乏支持灌洗、冲洗气管、抽吸和胸膜内纤溶治疗有效性的大量数据[3,6]。
本患者的初步表现包括因鲁斯梭杆菌感染引起的脓性渗出物,以及因肥厚型心肌病导致的心功能受损,其特征是低体温、低血压和嗜睡。在培养结果出来之前,医生立即开始使用阿莫西林-克拉维酸、马波沙星和甲硝唑进行抗生素治疗,并同时进行输液治疗,有效减少了胸腔积液。
随后,抗生素药敏试验证实了药敏性,并据此继续使用初始抗生素。先前的研究报告显示,使用这些抗生素取得了成功的疗效,尤其是在联合使用需氧菌和厌氧菌的情况下,显著提高了存活率[10]。
复发时,患者的临床表现已发展为后纵隔食管旁积脓,与最初对抗生素治疗反应迅速的急性严重化脓性脓胸不同。尽管在培养中分离出了伯克霍尔德菌,并证明其对所使用的抗生素具有敏感性,但患者的临床状况仍在继续恶化。
与此相反,之前有研究报告称使用与初次治疗相同的抗生素成功治疗了复发性猫脓胸,这与本病例的情况不符[3]。与此相反,对狗的研究报告显示,狗的预后较差,复发后死亡率较高[16]。
鉴于通过细胞学或组织病理学检查未发现其他感染性病原体,而且即使培养出的细菌在体外也对治疗方案表现出敏感性,临床症状改善甚微,因此认为复发不太可能是由于初次发病时抗生素覆盖不足造成的。
总之,本病例报告记录了一只最初因细菌性脓胸和一过性心肌增厚而成功接受治疗的猫,它后来又因后纵隔食管旁积脓复发,且对单用抗生素毫无反应。外科干预措施包括开胸手术和长期胸腔造口管引流,并进行纤维蛋白溶解灌洗,结果完全治愈。
文献来源:Jang H, Kim S, Lee Y, Park J, Kwon H, Kim S, Sohn J, Kim JI, Jung DI. Successful Management of Recurrent Pyothorax in a Cat: Clinical Findings with Medical and Surgical Approaches. Animals (Basel). 2025 Apr 29;15(9):1253.
参考文献
1.Waddell L.S., Brady C.A., Drobatz K.J. Risk factors, prognostic indicators, and outcome of pyothorax in cats: 80 cases (1986–1999) J. Am. Vet. Med. Assoc. 2002;221:819–824.
2.Barrs V.R., Allan G.S., Martin P., Beatty J.A., Malik R. Feline pyothorax: A retrospective study of 27 cases in Australia. J. Feline Med. Surg. 2005;7:211–222.
3.Krämer F., Rainer J., Bali M.S. Short- and long-term outcome in cats diagnosed with pyothorax: 47 cases (2009–2018) J. Small Anim. Pract. 2021;62:669–676.
4.Stillion J.R., Letendre J.A. A clinical review of the pathophysiology, diagnosis, and treatment of pyothorax in dogs and cats. J. Vet. Emerg. Crit. Care. 2015;25:113–129.
5.Nelson R.W., Couto C.G. Small Animal Internal Medicine-E-Book. Elsevier Health Sciences; St. Louis, MO, USA: 2019.
6.Little S.E. The Cat-E-Book. Elsevier Health Sciences; St. Louis, MO, USA: 2024.
7.Anastasio J., Sharp C., Needle D. Histopathology of lung lobes in cats with pyothorax: 17 cases (1987–2010); Proceedings of the 18th International Veterinary Emergency & Critical Care Symposium (IVECCS); San Antonio, TX, USA. 8–12 September 2012.
8.Davies C., Forrester S.D. Pleural effusion in cats: 82 cases (1987 to 1995) J. Small Anim. Pract. 1996;37:217–224.
9.Boothe H.W., Howe L.M., Boothe D.M., Reynolds L.A., Carpenter M. Evaluation of outcomes in dogs treated for pyothorax: 46 cases (1983–2001) J. Am. Vet. Med. Assoc. 2010;236:657–663.
10.Fujii Y., Suwa A., Tsuyuki Y., Koyama K., Nio-Kobayashi J., Yoshii K. The First Case of a Cat Infected with Burkholderia pseudomultivorans, a Member of the Burkholderia cepacia Complex. Vet. Sci. 2024;11:559.
11.Gruget E., Cabon Q., Gory G. Description of the CT evolution of pyothorax and a caudal mediastinal paraesophageal empyema in a cat. Vet. Rec. Case Rep. 2022;10:e221.
12.Jung J., Choi M. Nonsurgical resolution of caudal mediastinal paraesophageal abscess in a cat. J. Vet. Med. Sci. 2015;77:499–502.
13.Sivacolundhu R.K., O’Hara A.J., Read R.A. Thoracic actinomycosis (arcanobacteriosis) or nocardiosis causing thoracic pyogranuloma formation in three dogs. Aust. Vet. J. 2001;79:398–402.
14.Gendron K., McDonough S.P., Flanders J.A., Tse M., Scrivani P.V. The pathogenesis of paraesophageal empyema in dogs and constancy of radiographic and computed tomography signs are linked to involvement of the mediastinal serous cavity. Vet. Radiol. Ultrasound. 2018;59:169–179.
15.Brissot H.N., Burton C.A., Doyle R.S., Bray J.P. Caudal mediastinal paraesophageal abscesses in 7 dogs. Vet. Surg. 2012;41:286–291.
16.MacPhail C.M. Medical and surgical management of pyothorax. Vet. Clin. N. Am. Small Anim. Pract. 2007;37:975–988.