
| 一般情况 | |
 | 品种:短毛猫 |
| 年龄:12岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:原发性肝脂质沉积症 | |
01 主诉及病史
出现厌食和呕吐。
没有明显病史,但在和主人搬家后的2个月内体重减轻。
02 检查
肝酶活性升高(碱性磷酸酶141 U/l,丙氨酸转氨酶474 U/l,天冬氨酸转氨酶76 U/l,总胆红素2.7 mg/dl)。
超声提示肝脂质沉积,特征为弥漫性轻度肝肿大伴边缘钝化、肝脏回声均匀增加、超声束衰减增加和肝内血管边界可视化差。主人拒绝了肝脏细针穿刺活检。
根据应激性厌食和呕吐病史、血液检查结果和超声指标,考虑诊断为原发性肝脂质沉积症。
放置了一根5 Fr鼻饲管,以25%的静息能量需求(RER)开始流质饮食,在4天内增加到100%。药物包括维生素K(1 mg/kg,SC,q24h)、马罗吡坦(1 mg/kg,SC,q24h)、甲氧氯普胺(0.5 mg/kg,SC,q12h)、钴胺素(250 μg/猫,SC,一次)、甲硝唑(15 mg/kg,IV,q12h)、埃索美拉唑(1 mg/kg,IV,q24h)、肝脏补充剂 (1片,PO,q24h)和左旋肉碱(330 mg,PO,q24h)。
住院期间呕吐减少,总胆红素降至0.6 mg/dl。为了减轻住院压力,5天后携带鼻饲管出院。口服药物包括熊去氧胆酸7.5 mg/kg、水飞蓟素10 mg/kg、甲氧氯普胺0.5 mg/kg、甲硝唑15 mg/kg、埃索美拉唑0.75 mg/kg,均q12h。出院2天后,病情恶化,出现呕吐和血液指标恶化(碱性磷酸酶304 U/l,总胆红素1.4 mg/dl),再次入院。尽管使用鼻饲管喂养,但还是持续流涎。
03 治疗
为了确保足够的营养并解决流涎问题,使用了16 Fr G管放置了经皮内窥镜胃造瘘(PEG)管。手术进行时没有出现并发症,内窥镜检查证实PEG管在胃中放置正确。
术后2小时,PEG管绷带上的血迹表明插入部位出血。腹部超声和CT显示脾穿孔(下图)。计划进行腹腔探查术以解决持续出血和生命体征恶化的问题。
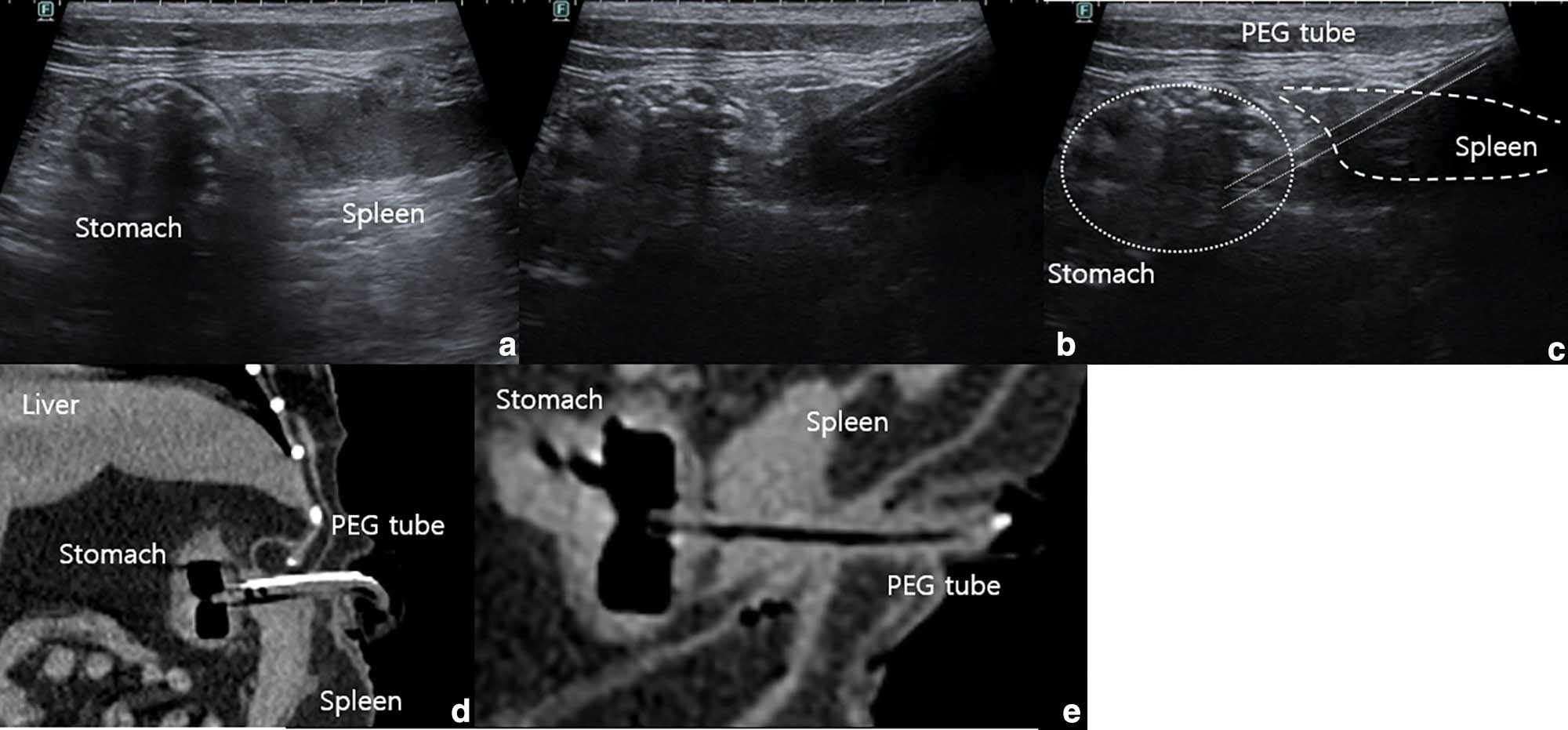
↑(a-c)腹部超声。部分脾实质和包膜受损,PEG管刺穿脾脏。(d-e)腹部CT显示PEG管穿孔。
术前用药后诱导全身麻醉。在脐部尾部做一个1 cm切口,并通过改良的Hasson技术插入5 mm套管针和套管。注入8-10 mmHg二氧化碳以建立气腹。
在中线头侧5 cm处放置一个的附加入口。引入了5 mm、30°、29 cm腹腔镜用于腹腔镜探查。腹腔镜检查显示肝脏肿大,边缘圆润,外观斑驳,颜色变黄,符合肝脂质沉积症(下图)。
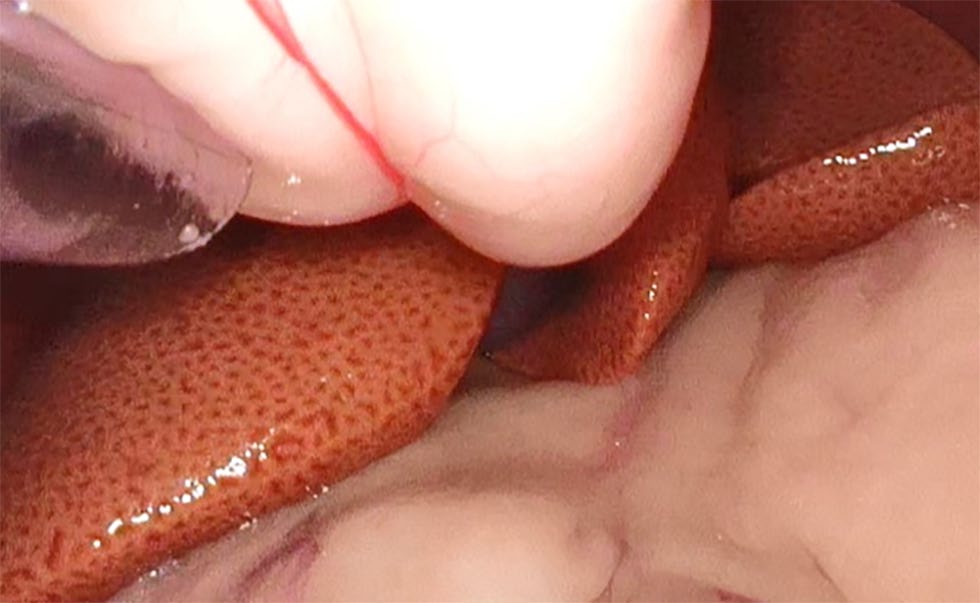
↑ 腹腔镜探查术。显示肝脏肿大,边缘圆润,外观斑驳,呈淡黄色。
可见PEG管穿孔脾脏(下图)。腹腔镜下进行了脾部分切除术,使用双极血管密封装置进行。使用腹腔镜抓钳重新定位PEG管。检查腹部无出血,手术结束。
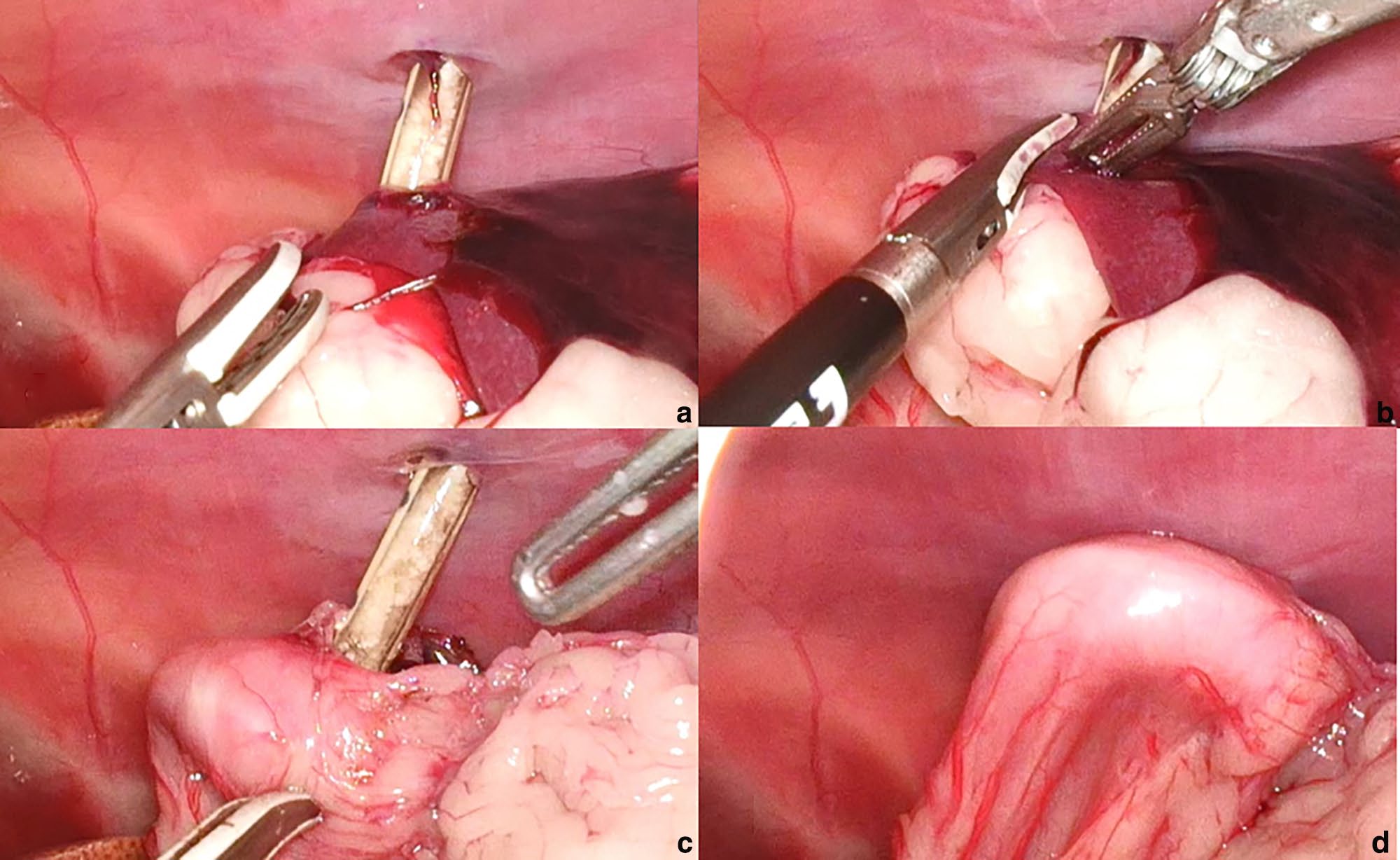
↑(a)在放置PEG管期间,脾脏穿孔并最终进入胃部。(b)使用双极血管密封装置,将穿透的脾脏部分切除为楔形。(c)确认切除被困在胃壁和腹壁之间的部分脾脏。(d)通过对腹壁外PEG管的牵引,使胃壁向外拉,导致与腹壁直接接触。
04 预后
术后恢复顺利,没有并发症(下图f)。曲马多(1 mg/kg,IV,q8h)用于治疗疼痛。随着血细胞比容从27.5%增加到31.4%,病情稳定,第二天使用阿莫西林克拉维酸(12.5 mg/kg,PO,q12h)后出院。
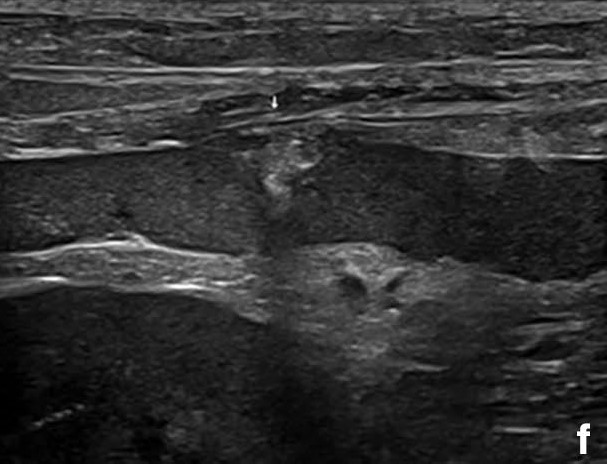
↑(f)腹部超声显示脾脏术后变化稳定。
术后4天,碱性磷酸酶(41 U/l)、丙氨酸转氨酶(51 U/l)、天冬氨酸转氨酶(22 U/l)、γ-谷氨酰转移酶(4 U/l)和总胆红素(0.2 mg/dl)恢复正常。
术后5天,白细胞增加到27.02×10^9/l,然后恢复正常。随访期间血细胞比容33.5%。血小板计数正常。
术后13天,所有血液检查参数完全恢复正常。口服药物包括熊去氧胆酸和水飞蓟素。
术后31天,MIC-KEY管用于更换PEG管。
术后45天,血液检查和食欲正常,所有药物均已停药。尽管治疗完成,但主人出于对厌食复发的担忧,决定保留MIC-KEY管。
4个月后,仍使用MIC-KEY管,并保持健康。与初次就诊相比,体重增加了500克,达到5公斤,体况评分提高5/9。
05 讨论
肝脂质沉积症是猫常见的肝脏疾病,需要积极的营养支持[1]。鼻饲管或鼻胃管通常用于短期营养需求,而食管造口管或胃造瘘管是长期支持的首选。
经皮内窥镜胃造瘘(PEG)管放置被认为对人类、狗和猫安全有效,可确保可靠的长期喂养[2-5]。然而,尽管PEG管放置一般安全,但其可导致罕见但严重的并发症,例如腹腔内器官(如脾脏、肝脏、小肠、结肠)损伤和大出血[5-9]。
放置PEG管的最常见适应症是猫的肝脂质沉积和口腔肿瘤,以及狗的食管疾病[3,4]。尽管通常认为放置PEG管是安全的,但人类和兽医学的几项研究记录了与PEG管放置相关的并发症,分类为轻微(如造口周围炎症、瘘管形成、管移位、气腹)和严重(如出血、内脏损伤、吸入性肺炎、腹膜炎)[2,3,5-9]。
本病例在PEG管放置过程中,置于右侧卧位,胃部充气,以提供清晰的视野和为PEG管提供安全的通道。使用内窥镜和手指触诊仔细检查插入部位,以最大限度地降低器官损伤的风险。放置PEG管时未偏离标准程序,未发现即时并发症。尽管采取了预防措施,但在手术后2小时,在插入部位观察到出血。
出血主要发生在PEG管插入部位,但也应考虑腹腔内出血。先前的兽医文献中没有研究报告猫放置PEG管引起的脾穿孔。在人类医学中,腹部手术史、异常解剖结构和严重肥胖等因素已被确定为PEG管放置期间并发症的潜在危险因素[2,6-9]。然而,在这只猫身上没有观察到这些因素,推测由于胃充气不足导致脾脏位于头侧位置,导致穿孔。
在PEG管放置期间,适当的胃充气可确保肝脏的头侧位置和脾脏、结肠的尾侧移位,从而降低器官损伤的风险。这一假设得到了一项涉及47只狗的研究的支持[14]。该研究发现,胃充气不足导致脾脏向头侧移动。如果未达到足够的胃充气,则应中止手术并评估其他通路选择。
同样,人类病例报告了由于胃充气不足而无意中将PEG管穿过结肠的情况[8]。除了胃充气不足外,经结肠错位在有腹部手术史或过度肥胖的患者中尤其常见[7]。为了防止此类并发症,可使用装满盐水的注射器来避免结肠渗透并确认准确放置[7,15]。
总之,本病例在放置PEG管期间,遇到了一种罕见的脾穿孔并发症,并使用腹腔镜脾部分切除术成功治疗。确保足够的胃充气和术后监测对于预防和解决并发症至关重要。微创腹腔镜被证明可有效治疗与猫放置PEG管相关的罕见并发症,例如脾穿孔。
文献来源:Jun J, Park E, Sihn D, Jung J. Successful management of splenic perforation during percutaneous endoscopic gastrostomy tube placement in a cat via laparoscopic partial splenectomy. JFMS Open Rep. 2025 Apr 26;11(1):20551169251328957.
参考文献
1. Valtolina C, Favier RP. Feline hepatic lipidosis. Vet Clin North Am Small Anim Pract 2017; 47: 683–702.
2. Rahnemai-Azar AA, Rahnemaiazar AA, Naghshizadian R, et al. Percutaneous endoscopic gastrostomy: indications, technique, complications and management. World J Gastroenterol 2014; 20: 7739–7751.
3. Armstrong PJ, Hardie EM. Percutaneous endoscopic gastrostomy. A retrospective study of 54 clinical cases in dogs and cats. J Vet Intern Med 1990; 4: 202–206.
4. Bright RM, Okrasinski EB, Pardo AD, et al. Percutaneous tube gastrostomy for enteral alimentation in small animals. Compend Contin Educ Pract Vet 1991; 13: 16–23.
5. Salinardi BJ, Harkin KR, Bulmer BJ, et al. Comparison of complications of percutaneous endoscopic versus surgically placed gastrostomy tubes in 42 dogs and 52 cats. J Am Anim Hosp Assoc 2006; 42: 51–56.
6. Schrag SP, Sharma R, Jaik NP, et al. Complications related to percutaneous endoscopic gastrostomy (PEG) tubes. A comprehensive clinical review. J Gastrointestin Liver Dis 2007; 16: 407–418.
7. Boeykens K, Duysburgh I. Prevention and management of major complications in percutaneous endoscopic gastrostomy. BMJ Open Gastroenterol 2021; 8.
8. Kozyk M, Strubchevska K, Batke M. Transcolonic misplacement as a rare complication associated with PEG tube. Clin Case Rep 2022; 10.
9. Lau G, Lai SH. Fatal retroperitoneal haemorrhage: an unusual complication of percutaneous endoscopic gastrostomy. Forensic Sci Int 2001; 116: 69–75.
10. Webb CB. Hepatic lipidosis: clinical review drawn from collective effort. J Feline Med Surg 2018; 20: 217–227.
11. McDonough SP, Southard T. The liver and pancreas. In: Necropsy guide for dogs, cats, and small mammals. Hoboken, NJ: Wiley-Blackwell, 2017, pp 91–99.
12. Peksen C, Aktokmakyan TV, Savas OA, et al. Comparison of laparoscopic evaluation of hepatosteatosis with ultrasound findings. Eur Rev Med Pharmacol Sci 2023; 27: 9067–9075.
13. Ireland LM, Hohenhaus AE, Broussard JD, et al. A comparison of owner management and complications in 67 cats with esophagostomy and percutaneous endoscopic gastrostomy feeding tubes. J Am Anim Hosp Assoc 2003; 39: 241–246.
14. Clary EM, Hardie EM, Fischer WD, et al. Nonendoscopic antegrade percutaneous gastrostomy: the effect of preplacement gastric insufflation on tube position and intra-abdominal anatomy. J Vet Intern Med 1996; 10: 15–20.
15. McClave SA, Chang WK. Techniques in enteral access. In: Ginsberg GG. (ed). Clinical gastrointestinal endoscopy. Philadelphia, PA: Elsevier Saunders, 2005, pp 349–366.