
| 一般情况 | |
 | 品种:拉布拉多犬 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:去甲肾上腺素外渗 | |
01 主诉及病史
对美洲异毕吸虫(Heterobilharzia americana)感染进行治疗后1个月,出现持续性厌食、腹泻和体重减轻。
既往无体外寄生虫或皮肤病病史。
02 检查
通过腹部超声,诊断为肠套叠,准备接受剖腹探查术,并进行部分肠切除和吻合,以及肝脏和空肠的组织活检。
麻醉前90分钟,剃掉左前肢毛发并做好无菌准备,在头静脉放置20G外周静脉导管(PIVC)。放置PIVC时肢体上没有明显的病变。在麻醉前,将第二个PIVC放置在右足背静脉,以便在无法使用主要PIVC的情况下进行备用静脉通路。
接受芬太尼(3 μg/kg,IV,一次)和咪达唑仑(0.5 mg/kg,IV,一次)注射,用丙泊酚(1.3 mg/kg,IV,缓慢滴定)诱导麻醉。接受了插管和100%氧气机械通气。使用七氟醚(吸入0.8%-2%)、芬太尼(5-20 μg/kg/h,IV) 和氯胺酮恒速输注(1 mg/kg/h,IV)维持麻醉。利多卡因恒速输注(3 mg/kg/h,IV)用于额外镇痛。术中给予头孢西丁(30 mg/kg,IV,每90分钟)用于抗菌预防。还接受了5%犬冻干白蛋白输注以治疗低白蛋白血症并提供围手术期胶体支持。
在手术过程中,出现了全身性低血压,最低收缩压和平均动脉血压分别为80和52 mmHg。低血压最初通过静脉推注晶体液(乳酸林格氏液5 mL/kg,IV,2次)进行治疗。诱导后约2小时,开始去甲肾上腺素恒速输注(0.3 μg/kg/min,IV)用于治疗持续性低血压。
在接下来的2小时手术中,去甲肾上腺素恒速输注从0.3 μg/kg/min逐渐升高到1.5 μg/kg/min,在此期间,平均动脉压保持在60-80 mmHg之间。
在腹部闭合后,立即注意到在PIVC绷带近端的左前臂出现新的皮下水肿。用无菌盐水冲洗左前臂PIVC。芬太尼、利多卡因和去甲肾上腺素恒速输注被重新定位到备用右足背PIVC,乳酸林格氏液和白蛋白恒速输注暂停。
患者被运送到放射科,放置颈静脉中心静脉导管(CVC)和食管饲管。CVC放置后,去甲肾上腺素、芬太尼和利多卡因恒速输注重新转移到CVC,乳酸林格氏液和白蛋白恒速输注通过右足背PIVC重新启动。患者从麻醉中顺利恢复并返回ICU。
麻醉恢复后,左前肢PIVC被移除,露出以PIVC插入部位为中心的新病灶。病变约为2×3 cm,为凸起、增厚、明显疼痛的斑块,最初颜色仅比周围皮肤略深,周围皮肤发白。肢体周围斑块有中度皮下水肿。在去除PIVC之前,既没有抽吸PIVC,也没有用无菌盐水冲洗皮下间隙。患肢没有抬高,在PIVC去除后,热敷外渗部位约10分钟。
03 治疗
推测外渗去甲肾上腺素的最大可能体积为28 mL 100 μg/mL去甲肾上腺素溶液,总共产生2.8 mg去甲肾上腺素。
在去甲肾上腺素注射后11小时内、发现外渗后5小时内进行酚妥拉明输注。两瓶5 mg甲磺酸酚妥拉明是从当地一家人类医院获得的。每个5 mg瓶用5 mL无菌盐水复溶,产生10 mL的1 mg/mL甲磺酸酚妥拉明溶液。
将10 mL的1%甲磺酸酚妥拉明溶液吸入单个12 mL注射器中,并使用多个新的25G皮下注射针头在PIVC插入部位周围给药。在酚妥拉明输注期间及此后30 min,血压保持正常。
04 预后
在酚妥拉明注射部位迅速形成红斑,红斑是圆形、边缘良好的、不同程度的凸起,大小不一(直径3-10毫米),其中一些在拔针时渗出一个小出血泡(下图)。外渗区的皮肤逐渐恢复了粉红色。
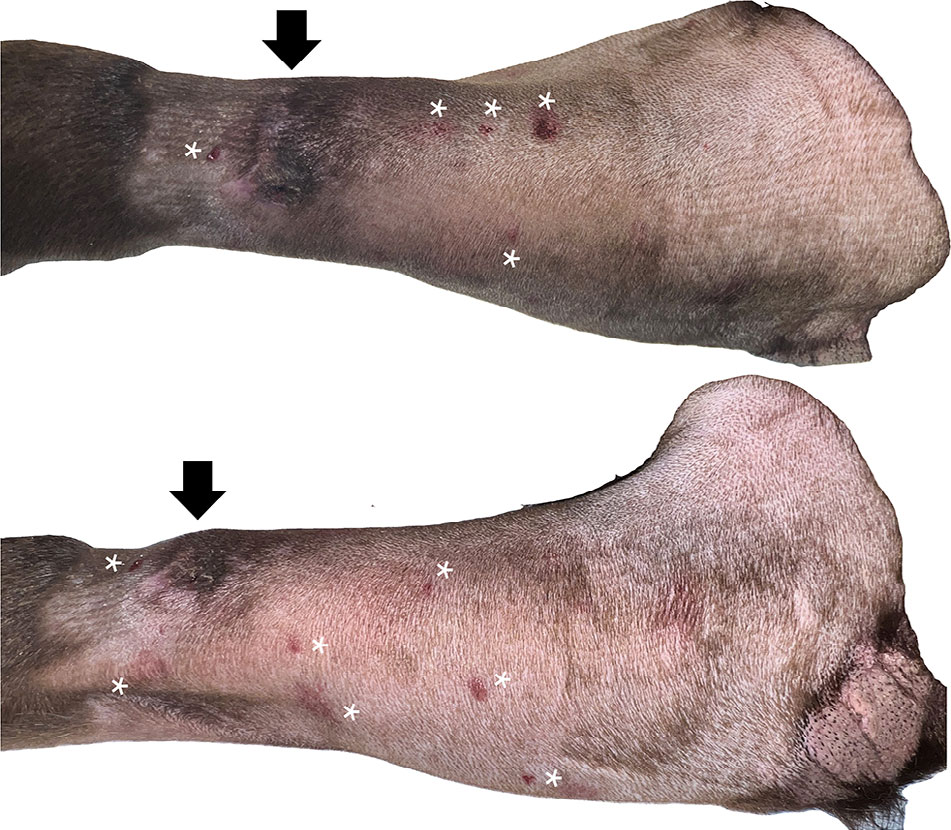
↑ 输注酚妥拉明后约2小时,去甲肾上腺素外渗部位的头侧(上图)和外侧(下图)显示斑块集中在外周静脉导管插入部位(箭头),可见在每个酚妥拉明注射部位形成的红斑(*)。
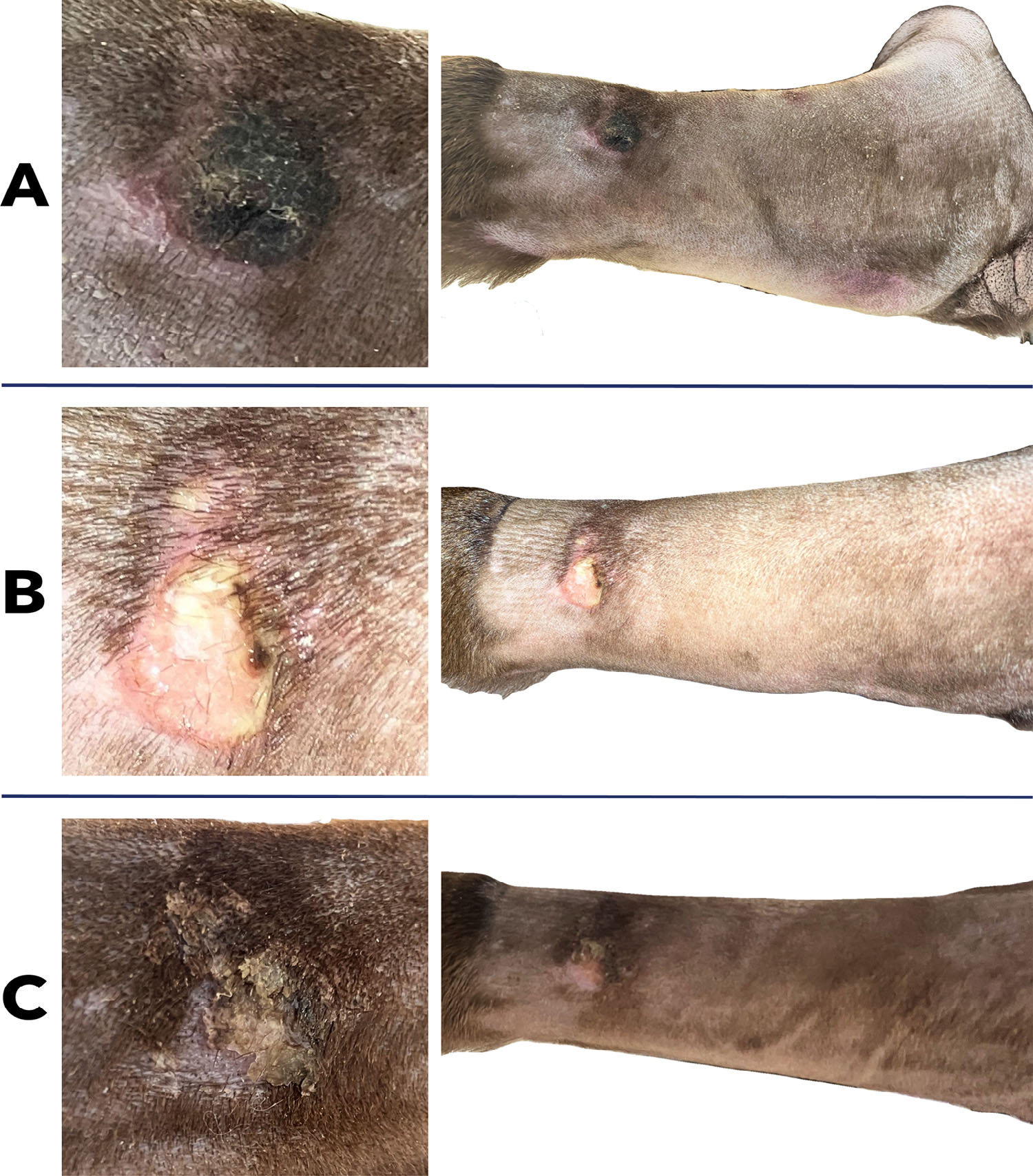
外渗后12小时,真皮斑块出现坏死,颜色近黑色,更厚,更隆起,边缘清晰,只有一层薄薄的红斑皮肤边界将斑块与周围的健康表皮隔开(下图A)。
外渗后36小时,真皮斑块脱落,露出约2×3 cm的浅层、无痛、轻度渗出性真皮溃疡(下图B)。给溃疡覆盖一个小的弹性绷带。每天或隔天更换一次。
外渗后7天,真皮溃疡发展成无痛、无渗出的结痂(下图C左)。皮下水肿逐渐消退。
外渗后9天,结痂几乎完全脱落,露出健康的表皮(下图C右)。
肝脏和空肠活检的组织病理学结果显示播散性淋巴瘤,怀疑是继发于美洲异毕吸虫病的恶性转化。
术后10天,由于预后不良,患者被安乐死。尸检时在外渗部位仅观察到一小块浅表结痂。
05 讨论
去甲肾上腺素是人类和兽医学中脓毒性休克患者最常用的血管加压药[1,2]。去甲肾上腺素是一种有效的α-1和α-2肾上腺素能受体激动剂,也是一种中度的β-1受体激动剂[2]。
α-肾上腺素能受体激活的结果是严重的外周血管收缩[2]。去甲肾上腺素和其他血管加压药的外渗可引起局部组织缺血和坏死,因为它们具有强大的血管收缩作用[3]。
为了降低血管加压药外渗的风险,人类指南传统上推荐通过中心静脉导管(CVC)而非外周静脉导管(PIVC)给予去甲肾上腺素[3]。在治疗脓毒性休克的动物时,2021年的指南建议通过PIVC给予血管加压药,以尽快恢复血压,而不是等到放置CVC后才开始治疗[4]。如果需要通过PIVC给药血管加压药,人类指南建议使用≥20G的PIVC≤4小时[5]。
酚妥拉明是一种有效的短效α-肾上腺素能受体拮抗剂,是人类医学中唯一获得美国食品药品监督管理局批准的去甲肾上腺素外渗治疗方法[3,6]。酚妥拉明可对抗大多数α-肾上腺素能血管加压药(如肾上腺素、多巴酚丁胺、多巴胺、去甲肾上腺素和去氧肾上腺素)外渗引起的血管收缩[6]。
去甲肾上腺素酒石酸氢盐1 mg/mL注射液的药物标签上有一个黑框警告,提供酚妥拉明作为“外渗缺血解毒剂”的给药说明[7]。根据去甲肾上腺素黑框警告和目前的人类文献,在发现外渗后,应尽快用10-15 mL含有5-10 mg酚妥拉明的盐水溶液浸润血管加压药外渗部位[3,7-9]。
使用细皮下注射针头,应将酚妥拉明溶液充分浸润整个外渗区域[7]。当在去甲肾上腺素外渗后12小时内给药时,酚妥拉明诱导的交感神经阻滞可以通过引起局部血管舒张来减少组织缺血并预防坏死[7]。酚妥拉明给药后,应监测患者的并发症,包括低血压、充血和组织再灌注引起的疼痛[9]。
在兽医学中,描述血管加压药外渗事件发生、治疗和结局的同行评审文献有限,血管加压药外渗的发生率目前尚不清楚。在人类中,一项系统评价报道了325例血管加压药外渗事件,其中204例导致局部组织损伤,包括皮肤坏死、组织坏死和坏疽[10]。其中97.8%由外周静脉给药引起,仅2.2%由CVC给药引起,但未调查总发生率[10]。
一项纳入11项研究(包括16,055名成人患者)的荟萃分析显示,与外周静脉血管加压药给药相关的不良事件的汇总发生率仅为1.8%,而一项纳入4项研究(包括388名儿童)的荟萃分析估计这一发生率为3.3%[11]。
另一项系统评价纳入了7项队列研究,包括1362例成人休克患者,记录了35例血管加压药外渗的发生率为3.4%,均未导致组织坏死或肢体缺血[12]。鉴于血管加压药在兽医麻醉和重症监护中频繁使用,有必要增加对血管加压药外渗事件发生和结局的报告,以确定临床意义。
记录酚妥拉明在动物中给药的安全性和有效性的研究极少,在1957年的一项实验研究中,狗在50-70分钟内接受稀释的去甲肾上腺素溶液皮下输注,这通常导致组织坏死和脱落[14]。其中一些狗在皮下去甲肾上腺素给药部位的边缘和周围接受了10 mg酚妥拉明皮下注射,当立即或外渗后12小时内注射到外渗区域时,酚妥拉明输注在预防去甲肾上腺素诱导的组织坏死方面非常有效[14]。此外,酚妥拉明对血压没有影响[14]。
在本研究中,输注酚妥拉明后,外渗区域的颜色迅速从白变为粉色,这支持了对治疗的积极反应[6]。此外,作者认为红斑是每次酚妥拉明输注部位突然、深度、局灶性血管舒张的结果,进一步支持对治疗的积极反应。
总之,在兽医学中,对这一主题的未来研究是必要的,包括动物血管加压药外渗事件的患病率和结局的表征以及替代选择的治疗建议。此外,有必要进行专门用于血管加压药安全给药和预防外渗的兽医研究。
文献来源:Flynn GE, Riffe CI, Aicher KM, Wheeler LR. Phentolamine Infusion for the Treatment of Norepinephrine Extravasation in a Dog. J Vet Emerg Crit Care (San Antonio). 2025 Mar-Apr;35(2):156-161.
参考文献
1. Singer M., Deutschman C. S., Seymour C. W., et al., “The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis‐3),” JAMA 315, no. 8 (2016): 801–810.
2. Murphy K. M., Rishniw M., and Silverstein D. C., “Use of Vasopressors for Treatment of Vasodilatory Hypotension in Dogs and Cats by Diplomates of the American College of Veterinary Emergency and Critical Care,” Journal of Veterinary Emergency and Critical Care 32, no. 6 (2022): 714–722.
3. Stefanos S. S., Kiser T. H., MacLaren R., Mueller S. W., and Reynolds P. M., “Management of Noncytotoxic Extravasation Injuries: A Focused Update on Medications, Treatment Strategies, and Peripheral Administration of Vasopressors and Hypertonic Saline,” Pharmacotherapy 43, no. 4 (2023): 321–337.
4. Evans L., Rhodes A., Alhazzani W., et al., “Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021,” Intensive Care Medicine 47, no. 11 (2021): 1181–1247.
5. Nguyen T. T., Surrey A., Barmaan B., et al., “Utilization and Extravasation of Peripheral Norepinephrine in the Emergency Department,” American Journal of Emergency Medicine 39 (2021): 55–59.
6. David V., Christou N., Etienne P., et al., “Extravasation of Noncytotoxic Drugs,” Annals of Pharmacotherapy 54, no. 8 (2020): 804–814.
7. DailyMed , “Levophed(R) Norepinephrine Bitartrate Injection,” HF Acquisition Co., LLC.
8. Ong J. and Van Gerpen R., “Recommendations for Management of Noncytotoxic Vesicant Extravasations,”Journal of Infusion Nursing 43, no. 6 (2020): 319–343.
9. Reynolds P. M., MacLaren R., Mueller S. W., Fish D. N., and Kiser T. H., “Management of Extravasation Injuries: A Focused Evaluation of Noncytotoxic Medications,” Pharmacotherapy 34, no. 6 (2014): 617–632.
10. Loubani O. M. and Green R. S., “A Systematic Review of Extravasation and Local Tissue Injury From Administration of Vasopressors Through Peripheral Intravenous Catheters and Central Venous Catheters,” Journal of Critical Care 30, no. 3 (2015): 653.e9–653.e17.
11. Owen V. S., Rosgen B. K., Cherak S. J., et al., “Adverse Events Associated With Administration of Vasopressor Medications Through a Peripheral Intravenous Catheter: A Systematic Review and Meta‐Analysis,” Critical Care 25, no. 1 (2021): 146.
12. Tian D. H., Smyth C., Keijzers G., et al., “Safety of Peripheral Administration of Vasopressor Medications: A Systematic Review,” Emergency Medicine Australasia 32, no. 2 (2020): 220–227.
13. Lathroum C. N., Angulo Bracho H. L., Alessandrino K. M., and Walker J. M., “The Use of Injectable Subcutaneous Terbutaline and Topical Nitroglycerin Ointment in the Treatment of Peripheral Vasopressor Extravasation in 3 Dogs,” Journal of Veterinary Emergency and Critical Care 34, no. 4 (2024): 393–398.
14. Berben J. Y., Bryant M. F., and Howard J. M., “Etiology and Prevention of Sloughs Produced by L‐Norepinephrine (Levophed),” Annals of Surgery 146, no. 6 (1957): 1016–1020.