
| 一般情况 | |
 | 品种:苏格兰折耳猫 |
| 年龄:11岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:主动脉夹层 | |
01 主诉及病史
出现持续数天的呼吸困难和抑郁。
02 检查
体重2.95公斤。就诊时安静、警觉、反应灵敏,但呼吸困难。心率180 bpm,收缩压240 mmHg。血尿素氮轻度升高(38.3 mg/dL [17.6-32.8]),肌酐正常(1.6 mg/dL [0.8-1.8])。总T4为1.23 ug/dL [0.6-3.9],猫血清淀粉样蛋白A增加(22.5 ug/mL [0-5])。
初次就诊时的胸部X光片显示全心扩大,椎心评分增加9.6 [6.7-8.1],右尾肺叶轻度浸润(下图AC)。
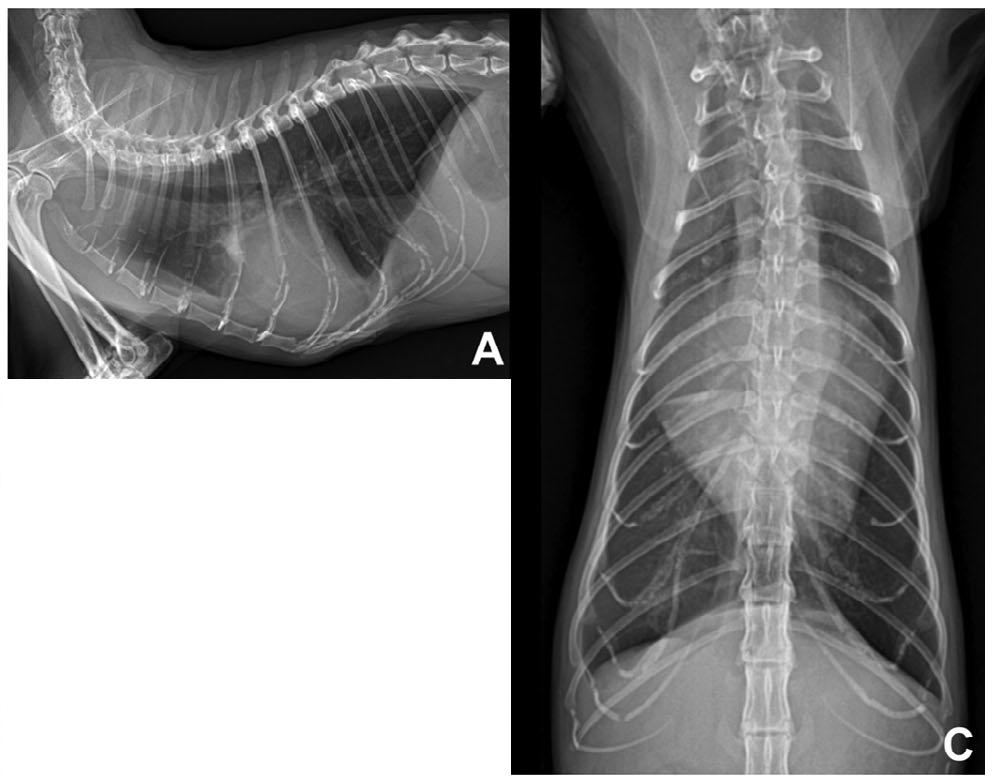
↑ 在右侧视图(A)和腹背视图(C)上观察到明显的心脏扩大,右尾肺叶有轻度肺部浸润。
超声心动图显示主动脉夹层(AD)从主动脉瓣水平延伸。在改良的左侧胸骨旁视图(下图A)和右侧胸骨旁长轴视图(下图B)上,具有回声结构的假腔似乎压迫了真腔。改良左侧胸骨旁视图上的彩色血流成像显示从主动脉射流到假腔(下图C)和主动脉瓣关闭不全(下图D)。假腔旁的回声病灶被认为是夹层引起的血肿。
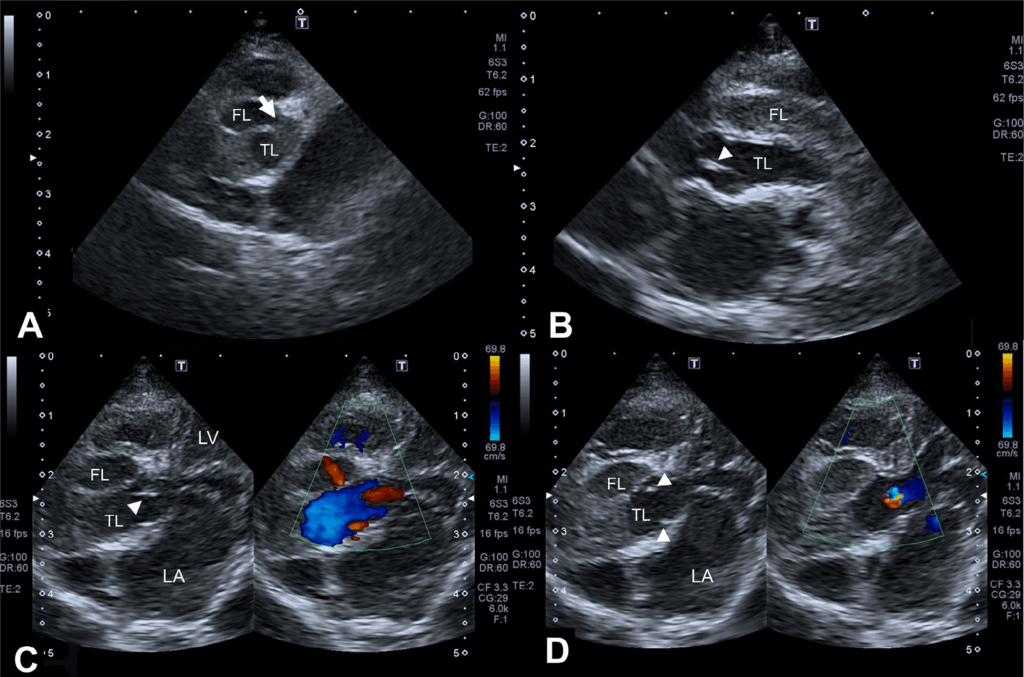
↑ 来自改良左心尖长轴视图(ACD)和右侧胸骨旁长轴视图(B)的经胸超声心动图图像。观察到将假腔(FL)和真腔(TL)分开的内膜瓣。FL和TL之间的缺陷(白色箭头)如图(A)所示。FL充满回声物质,怀疑是TL旁边流淌的血肿,由内膜瓣隔开(B)。在缺损水平,在收缩期从真腔到主动脉瓣(箭头)远端假腔的射流,表明两个腔(C)之间存在联系。确定了舒张期主动脉关闭不全(D)。但在回声病灶水平上没有观察到明显的流动。
连续波多普勒检查显示轻度主动脉瓣关闭不全(速度5.6 m/s,包膜不完整)和2 m/s的轻微三尖瓣反流。左心室(LV)肥大(LV舒张末期游离壁厚度0.79厘米 [0.26-0.45]),间歇性收缩期前运动发生轻度动态左心室流出道梗阻和左心房(LA)扩大(左心房与主动脉根部之比为2.06 [0.86-1.42])。
03 治疗
给予呋塞米(2mg/kg,IV)。
1天后,X光片显示肺水肿明显消退,呼吸频率18-24次/分。
2天后,出院服用处方药,呋塞米(1mg/kg,PO,q12h)和利伐沙班(1.25 mg,PO,q24h),持续两周。
04 预后
在为期两周的随访中,X光片上没有明显的肺水肿,病情稳定,睡眠呼吸频率、活力和食欲正常。但血尿素氮升高(92 mg/dL [17.6-32.8]),肌酐5.54 mg/dL [0.8-1.8]),磷轻度升高7 mg/dL [2.6-6]。呋塞米降至0.65 mg/kg PO q12h,持续1周,然后降至0.5 mg/kg PO q12h。维持利伐沙班的剂量。
在1个月和2个月的随访中,保持无症状。
在3个月随访的前一周,因呼吸困难和嗜睡就诊。影像学检查怀疑胸腔积液(下图BD),胸腔穿刺术显示乳糜胸。
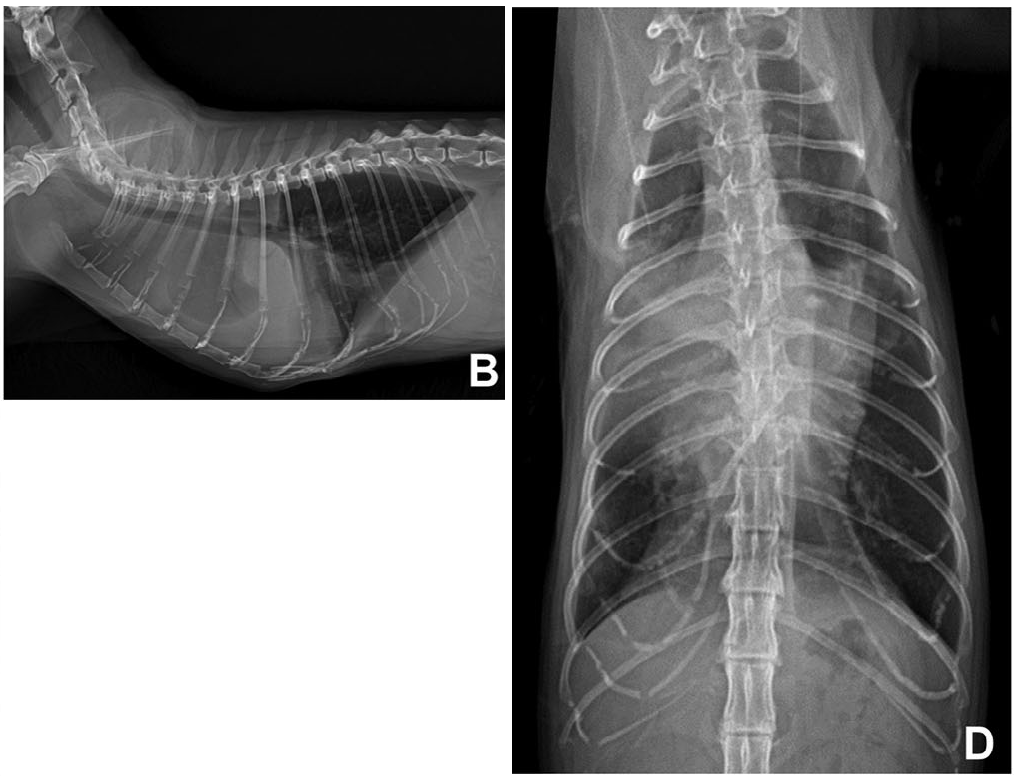
↑ 3个月后,肺明显回缩,观察到肺野前腹侧肺混浊增加,心脏轮廓边界消失,背腹视图(D)中叶间裂线明显。在右侧视图(B)和背腹视图观察到胸腔积液。
CT造影确定了从主动脉根部到降主动脉的主动脉壁钙化(下图C)。AD起源于主动脉瓣水平,向升主动脉延伸1.9 cm(下图D)。多平面重建显示对比增强的真腔和假腔(下图ABD)。观察到由假腔和非增强病变(疑似血肿)组成的夹层,似乎将主动脉从主动脉根部水平压迫到近端升主动脉(下图B)。对比增强的假腔似乎具有螺旋路线,围绕主动脉根部,并且在主动脉瓣水平有一个2.7 mm的壁缺损,两个管腔都通过该缺损进行沟通(下图EF)。
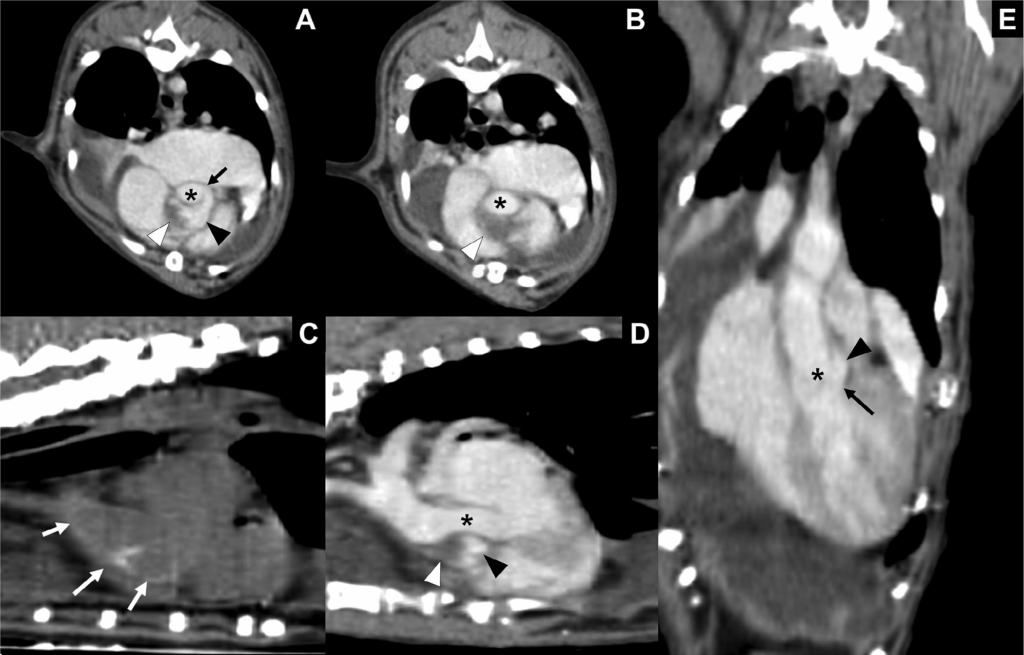
↑ 主动脉夹层的轴向(AB)和多平面重建CT图像(C-E)。确定了主动脉的真腔(黑色星号)和假腔(黑色三角),通过疑似夹层的缺损(黑色箭头)连接(A)。主动脉的假腔(黑色箭头)和非对比增强病变(白色箭头)组成喙形病变(B),它从轴向和重建图像中压缩了主动脉的真腔(ABDE)。造影剂前重建图像显示从主动脉根部到升主动脉的主动脉壁钙化(白色箭头)(C)。钙化在夹层水平最为突出。图D显示了在主动脉根部水平压缩主动脉真腔的夹层。通过背像上的缺陷(黑色箭头)(E)显示了真腔和假腔(星号)之间的联系。在整个CT图像中观察到明显的胸腔积液。
由于临床症状恶化,包括乳糜胸的发展、反复呼吸困难和嗜睡,开具了呋塞米 (1.5 mg/kg,PO,q12h)、肼屈嗪(2.5 mg,PO,q12h)和利伐沙班(1.25 mg,PO,q24h)。
CT扫描后住院2天,出院用处方药呋塞米(1 mg/kg,PO,q12h)、米氮平(1.88 mg/猫,PO)和利伐沙班(1.25 mg/猫,PO)。在两周的随访中,确定了乳糜胸并进行了胸腔穿刺术。之后呋塞米的剂量增加至1.5 mg/kg PO q12h。
10周后因虚脱住院,随后死亡。尸检显示主动脉瓣水平的主动脉壁有2 mm的全层裂隙,主动脉周围有喙状管腔,比真腔大(下图AB),与CT和超声心动图结果一致。主动脉的组织病理学证实夹层,伴有纤维化(下图C-E)和夹层表面钙化。在LV中观察到心肌组织内的心肌细胞肥大(下图F)。在LV的心肌和心内膜中观察到纤维化(下图GH)。虽然未观察到肌纤维杂乱,但发现了心肌细胞肥大和心肌和LV心内膜的间质纤维化,表明与肥厚性心肌病密切相关。PAS染色未显示明显的多糖异常。
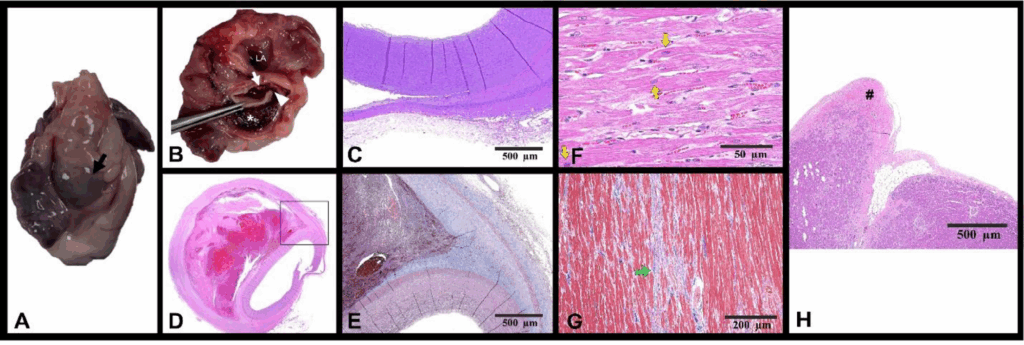
↑ 在肉眼尸检(A)中发现夹层水平的主动脉根部隆起(黑色箭头)。主动脉瓣水平2 mm的全层裂隙(箭头)和夹层血肿(星号)大于真腔。在裂隙(B)的右侧近端观察到主动脉瓣(白色箭头)。HE染色(C)和假腔中存在血栓(D)。Masson染色(E)对应于(D)中的黑色矩形区域。心肌中心肌细胞肥大(黄色箭头)(F)。Masson染色显示心肌纤维化(绿色箭头)(G)。HE染色显示心内膜纤维化(#)(H)。
05 讨论
主动脉夹层(Aortic dissection,AD)的特征是主动脉壁层分离,导致血液从管腔流入壁层。在人类中,AD与主动脉瓣关闭不全、多器官衰竭和死亡等并发症的高死亡率相关[1-3]。
在兽医学中,已经报道了几例小动物AD病例[4-14]。其中包括少数患有全身性高血压和肥厚性心肌病的猫。
虽然AD的完整病因尚不清楚,但认为AD潜在病理的基本组成部分是主动脉完整性受损,这是由于主动脉壁的先天性或后天性不稳定[11]。在人类医学中,全身性高血压、遗传疾病、主动脉瘤、动脉粥样硬化、既往心血管手术和炎症性疾病是AD的诱发因素[1-3,8]。
影像学检查可用于检测AD,包括超声心动图、CT、MRI和主动脉造影[14]。一份病例报告描述了猫AD的CT特征,但没有进行尸检以与CT结果进行比较。
本病例显示从主动脉根部到近端降主动脉的主动脉壁钙化。血管钙化是矿物质在血管系统中的病理沉积,与人类动脉粥样硬化、高血压、遗传因素和糖尿病等各种疾病有关[15-17]。
患有严重慢性肾功能衰竭、全身性高血压以及慢性主动脉和二尖瓣心内膜炎的猫存在主动脉和心脏矿化[18-21]。尽管病因复杂,但潜在的诱发因素,如全身性高血压(可导致主动脉变性)或主动脉钙化本身,可能已经对血管顺应性、主动脉僵硬、血管舒缩和斑块稳定性产生不利影响,从而导致AD[22]。
此外,在初步诊断后三个月进行CT扫描,因此,它可以是解剖后的后续变化。尽管有争议的人类研究报告称A型AD与动脉粥样硬化的患病率较低有关,但缺乏调查猫这种关系的文献[23,24]。
总之,本报告描述了通过超声心动图、CT和尸检诊断的主动脉钙化和乳糜胸猫的AD特征。这是第一份描述猫AD的CT和尸检特征的报告。虽然罕见,但AD应被视为患有全身性高血压、主动脉变性、肥厚性心肌病的猫的潜在并发症,以及作为乳糜胸猫的鉴别诊断。
文献来源:Ji Y, Kim M, Kim B, Oh SI, Oh B, Yoon H. Multimodal Imaging and Clinical Features of Aortic Dissection in a Cat. Vet Med Sci. 2025 May;11(3):e70359.Araújo RLS
参考文献
[1] Khan, I. A. , and Nair C. K.. 2002. “Clinical, Diagnostic, and Management Perspectives of Aortic Dissection.” Chest 122: 311–328.
[2] Mészáros, I. , Mórocz J., Szlávi J., etal. 2000. “Epidemiology and Clinicopathology of Aortic Dissection.” Chest 117: 1271–1278.
[3] Nienaber, C. A. , Clough R. E., Sakalihasan N., etal. 2016. “Aortic Dissection.” Nature Reviews Disease Primers 2: 1–18.
[4] Bevilacqua, G. , Camici P., and L’abbate A.. 1981. “Spontaneous Dissecting Aneurysm of the Aorta in a Dog.” Veterinary Pathology 18: 273–275.
[5] Boulineau, T. M. , Andrews‐Jones L., and Van Alstine W.. 2005. “Spontaneous Aortic Dissecting Hematoma in Two Dogs.” Journal of Veterinary Diagnostic Investigation 17: 492–497.
[6] Cohen, J. A. , Bulmer B. J., Patton K. M., and Sisson D. D.. 2010. “Aortic Dissection Associated With an Obstructive Aortic Chondrosarcoma in a Dog.” Journal of Veterinary Cardiology 12: 203–210.
[7] Daniel Newhard, S. J. 2017. “What is Your Diagnosis?” Journal of the American Veterinary Medical Association 250 no. 1.
[8] Gouni, V. , Papageorgiou S., Debeaupuits J., Damoiseaux C., Pouchelon J., and Chetboul V.. 2018. “Aortic Dissecting Aneurysm Associated With Systemic Arterial Hypertension in a Cat.” Schweizer Archiv Fur Tierheilkunde 160: 320–324.
[9] Lenz, J. A. , Bach J. F., Bell C. M., and Stepien R. L.. 2015. “Aortic Tear and Dissection Related to Connective Tissues Abnormalities Resembling Marfan Syndrome in a Great Dane.” Journal of Veterinary Cardiology 17: 134–141.
[10] Lourenço, M. L. , Vailati M. C., Luis A., Sequeira J. L., Peres J. A., and Gimenes S. M.. 2002. “Dissecting Aortic Aneurysm in a Cat.” Canadian Veterinary Journal 43: 720.
[11] Oricco, S. , Perego M., Poggi M., Tursi M., Biasato I., and Santilli R. A.. 2019. “Aortic Dissection in Four Cats: Clinicopathological Correlations.” Journal of Veterinary Cardiology 25: 52–60.
[12] Scollan, K. , and Sisson D.. 2014. “Multi‐Detector Computed Tomography of an Aortic Dissection in a Cat.” Journal of Veterinary Cardiology 16: 67–72.
[13] Waldrop, J. E. , Stoneham A. E., Tidwell A. S., Jakowski R. M., Rozanski E. A., and Rush J. E.. 2003. “Aortic Dissection Associated With Aortic Aneurysms and Posterior Paresis in a Dog.” Journal of Veterinary Internal Medicine 17: 223–229.
[14] Wey, A. C. , and Atkins C. E.. 2000. “Aortic Dissection and Congestive Heart Failure Associated With Systemic Hypertension in a Cat.” Journal of Veterinary Internal Medicine 14: 208–213.
[15] Demer, L. L. , and Tintut Y.. 2014. “Inflammatory, Metabolic, and Genetic Mechanisms of Vascular Calcification.” Arteriosclerosis, Thrombosis, and Vascular Biology 34: 715–723.
[16] Iribarren, C. , Sidney S., Sternfeld B., and Browner W. S.. 2000. “Calcification of the Aortic Arch: Risk Factors and Association With Coronary Heart Disease, Stroke, and Peripheral Vascular Disease.” Jama 283: 2810–2815.
[17] Wu, M. , Rementer C., and Giachelli C. M.. 2013. “Vascular Calcification: An Update on Mechanisms and Challenges in Treatment.” Calcified Tissue International 93: 365–373.
[18] Lamb, M. A. , Kleine L. J., and McMillan M. C.. 1991. “Diagnosis of Calcification on Abdominal Radiographs.” Veterinary Radiology 32: 211–220.
[19] Keppie, N. , Nelson N., and Rosenstein D.. 2006. “Imaging Diagnosis: Mineralization of the Aorta, Celiac and Cranial Mesenteric Arteries in a Cat With Chronic Renal Failure.” Veterinary Radiology and Ultrasound 47: 69–71.
[20] Lefbom, B. K. , Adams W. H., and Weddle D. L.. 1996. “Mineralized Arteriosclerosis in a Cat.” Veterinary Radiology and Ultrasound 37: 420–423.
[21] Malik, R. , Barrs V. R., Church D. B., etal. 1999. “Vegetative Endocarditis in Six Cats.” Journal of Feline Medicine and Surgery 1: 171–180.
[22] Patel, P. A. , Bavaria J. E., Ghadimi K., etal. 2018. “Aortic Regurgitation in Acute Type‐A Aortic Dissection: A Clinical Classification for the Perioperative Echocardiographer in the Era of the Functional Aortic Annulus.” Journal of Cardiothoracic and Vascular Anesthesia 32: 586–597.
[23] Achneck, H. , Modi B., Shaw C., etal. 2005. “Ascending Thoracic Aneurysms are Associated With Decreased Systemic Atherosclerosis.” Chest 128: 1580–1586.
[24] Grewal, N. , Dolmaci O., Jansen E., et al. 2023. “Are Acute Type a Aortic Dissections Atherosclerotic?” Frontiers in Cardiovascular Medicine 9: 1032755.