
| 一般情况 | |
 | 品种:混种犬 |
| 年龄:14岁 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:碰撞瘤 | |
01 主诉及病史
腰骶区肿胀3个月,尺寸约6.5×5厘米,细针穿刺细胞学提示脂肪瘤。
02 检查
体重11.9公斤。表现出疼痛、起身困难和无法爬楼梯。神经系统评估显示后肢异常,包括姿势反应改变、屈肌反射消失和肌张力降低。尾巴没有运动,肌肉张力降低。脊髓触诊引起腰骶区疼痛。神经系统检查结果表明病变局限于马尾段。
脊髓造影显示L6的前关节突、椎板和椎体以及L4、L5和L7椎板存在骨溶解(下图A)。在L6椎骨观察到造影剂突然中断和充盈缺损(下图AB)。由于第6腰椎的骨骼受累,马尾压迫可能带有肿瘤成分。
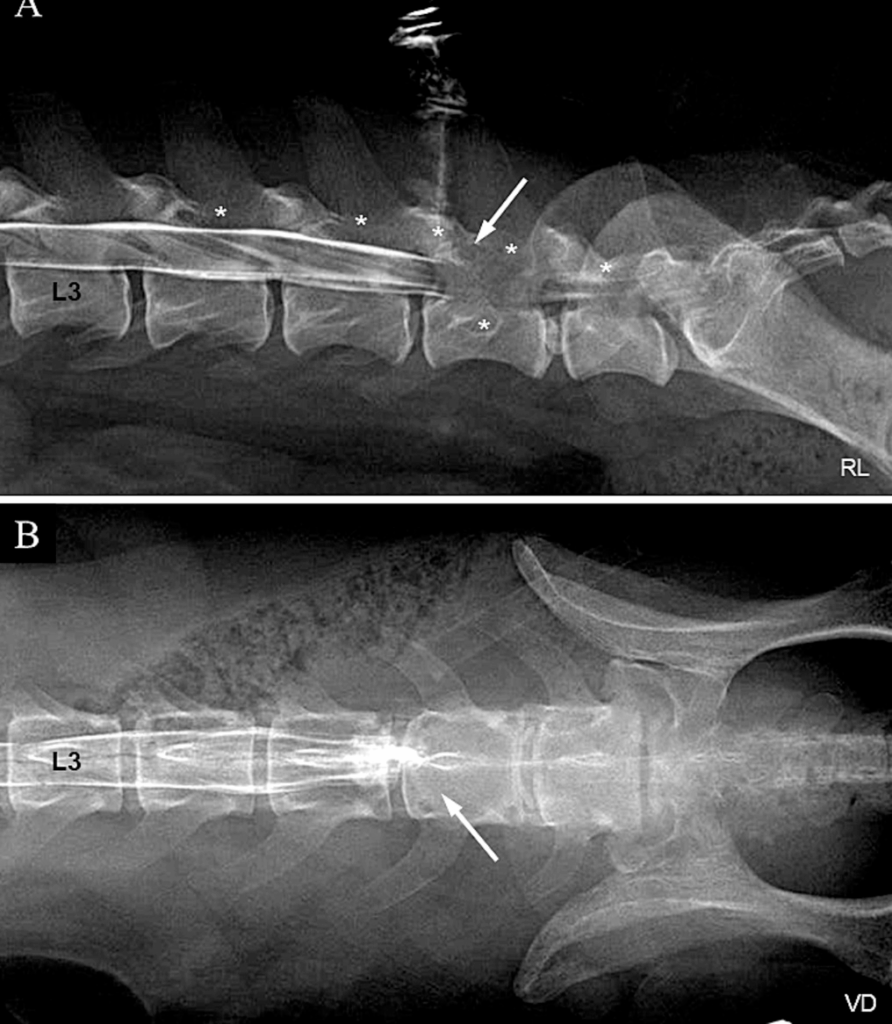
↑(A)腰椎右侧脊髓造影显示L6的前关节突、椎板和椎体以及L4、L5和L7的椎板中的骨溶解(*)。在L6处观察到突然的造影剂中断和填充缺陷(白色箭头)。(B)腰椎腹背脊髓造影显示突然的造影剂中断和L6处的充盈缺损(白色箭头)。
03 治疗
进行手术干预以去除L6-S1背侧区域的疑似脂肪瘤。在第6和第7腰椎之间进行了椎板切除术,以减压马尾神经根(下图AB)。在手术过程中,L6的棘突表现出易碎的质地(下图C),并观察到从椎管延伸出的红色物质(下图D)。
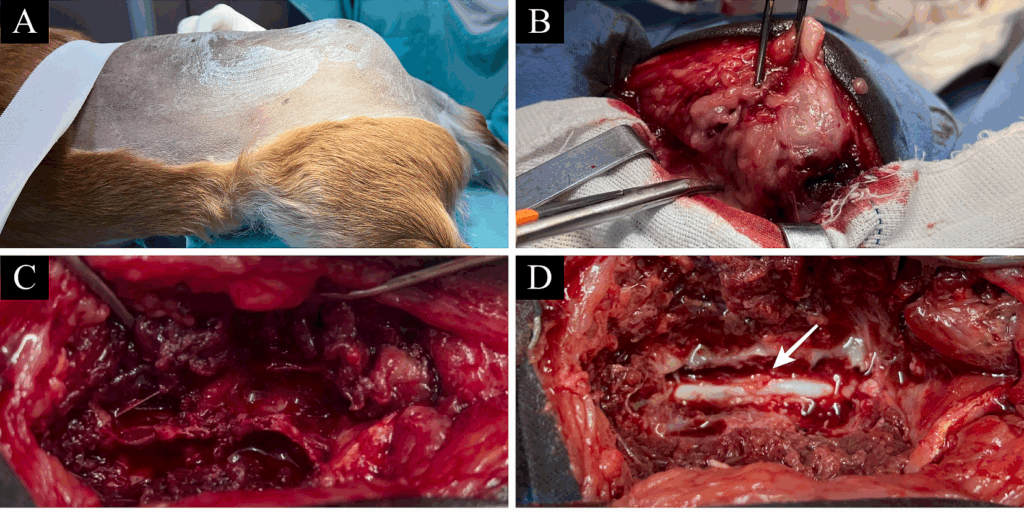
↑(A)接受术前消毒的斜躺患者,显示腰骶区域明显肿大。(B)L6-L7背侧区域的肿物切除术,显示肿块与周围肌肉组织的粘附。(C)背侧椎板切除术,部分切除L6和L7棘突,突出L6棘突的脆性。(D)完全切除L6和L7棘突和椎板后完成脊髓暴露的背侧椎板切除术。在椎管内观察到淡红色的肿块(白色箭头)。
组织病理学检查显示,皮下肿块内共存两个肿瘤,多发性骨髓瘤延伸到第6腰椎的骨边缘之外,浸润椎周组织,在那里它与浸润性脂肪瘤合并(下图EF)。骨髓瘤区域由致密的圆形细胞增生组成。骨髓瘤细胞分化良好,具有明显的细胞边界以及嗜酸性粒细胞细胞质。细胞核是圆形的、均匀的,通常是偏心的、深染的,有聚集的染色质,有时有明显的核仁(下图G)。也存在双核细胞。在10个高功率视野中观察到10个有丝分裂象。浸润性脂肪瘤细胞分化良好,大的透明液泡取代了细胞质,细胞核外周化和压迫。这些细胞主要浸润周围的骨骼肌(下图H)。
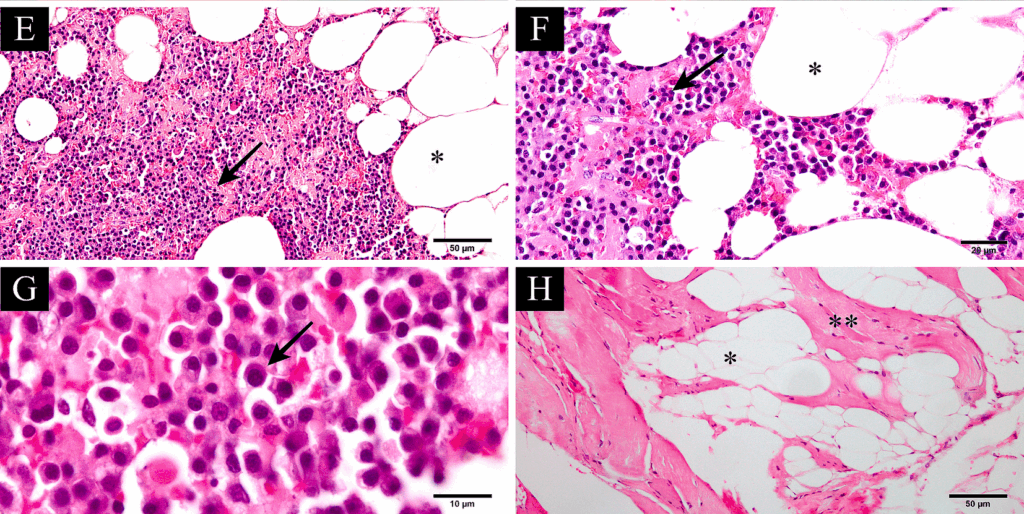
↑(E)分化良好的肿瘤脂肪细胞(浸润性脂肪瘤[*])与浆细胞的肿瘤性增殖(多发性骨髓瘤[黑色箭头])发生碰撞。(F)分化良好的肿瘤脂肪细胞(*)散布着肿瘤浆细胞的增殖(黑色箭头)。(G)骨髓瘤细胞具有明显的细胞边界,嗜酸性粒细胞质(黑色箭头)。(H)有分化良好的肿瘤脂肪细胞(*)浸润骨骼肌组织(**)。
为了确认多发性骨髓瘤,进行了额外的免疫组化,但未显示CD20或MUM1的免疫反应性。尽管免疫组化是明确诊断的工具,但大约30%的病例可能缺乏这些免疫标志物的标记。
进行了全面的血液学评估,包括全血细胞计数和血清蛋白电泳,分别显示血小板减少和单克隆丙种球蛋白升高。溶骨性骨病变、组织病理学发现和单克隆丙种球蛋白升高证实了犬多发性骨髓瘤与浸润性脂肪瘤的碰撞瘤的诊断。
开始使用美法仑治疗,以5天为周期(每天7 mg/m2),间隔21天,联合泼尼松(0.4 mg/kg,每天一次),持续一年。随后泼尼松剂量减少至0.2 mg/kg。
04 预后
腰骶区域无疼痛迹象,恢复了尾部运动,术后两周成功爬楼梯。
在第一个化疗和抗炎治疗周期后,没有表现出疼痛迹象,丙种球蛋白减少。
术后两年半,仍在接受治疗,定期接受血清蛋白电泳,在此期间没有显示复发。
05 讨论
多发性骨髓瘤(Multiple myeloma,MM)是一种起源于骨髓浆细胞的恶性肿瘤,占狗所有恶性肿瘤的不足1%[1-4]。MM主要影响中老年犬[5],特别偏爱中轴骨[6,7]。MM通常与单克隆丙种球蛋白病和溶骨性骨病变有关[4],其临床表现因增殖程度、肿瘤位置和肿瘤浆细胞的播散而异[2]。
浸润性脂肪瘤代表了一种更具侵袭性的脂肪瘤,其特征是侵入邻近组织,包括肌肉、结缔组织和骨骼[8]。虽然不常见,但浸润性脂肪瘤可以侵入周围神经或延伸到椎管,可能导致脊髓压迫[9]。这种类型的脂肪瘤通常见于8-12岁的狗[10]。临床症状取决于肿瘤的位置,完全手术切除仍然是浸润性脂肪瘤最有效的治疗方法[11]。
碰撞瘤(Collision tumor)是一种不常见的现象,定义为在同一解剖部位共存两种不同的肿瘤,边界明确,没有组织学混合[12,13]。在狗中,已经记录了肿瘤的“碰撞”,脂肪瘤与其他肿瘤一起被发现,例如血管肉瘤[8]和肥大细胞瘤[14]。然而,此前还没有报道狗浸润性脂肪瘤和MM之间发生“碰撞”的病例。
大约50%的MM累及脊柱的狗表现出神经系统表现,例如脊柱触诊疼痛和神经功能缺损[15]。本病例的临床体征和神经系统检查与马尾综合征一致,主要由第6腰椎水平MM的神经根压迫引起,脊髓造影清楚地证明了这一点。
一项对12只具有MM神经系统体征的狗的研究发现,普通X光照相在3例中检测到单个病变,而MRI在9例中检测到多个骨病变,这表明MRI在检测多灶性骨骼受累方面具有卓越的灵敏度[7]。然而,在本病例中,术前平片显示多处溶骨病灶。
减压手术联合肿瘤切除是肿瘤诱导的马尾神经根压迫引起的神经功能缺损的狗的主要治疗选择。在外科手术过程中对不同水平组织改变的宏观识别促使仔细收集样本进行组织病理学检查,这对于诊断多发性骨髓瘤至关重要。该分析揭示了两种不同肿瘤的共存:一种浸润性脂肪瘤,位于与MM相关的椎周组织中。
总之,该病例强调了浸润性脂肪瘤和MM之间罕见的肿瘤碰撞,凸显了全面诊断方法的重要性。准确的诊断使有效的化疗方案得以实施,使患者能够存活超过925天。此外,尽管观察到神经、结构和组织病理学改变,但适当化疗的预后证明是良好的。
文献来源:Recce AB, Mangini LT, Malvessi VC, Kommers GD, Mazzanti A, Beckmann DV. Collision tumor of myeloma and infiltrative lipoma in the canine spine. Res Vet Sci. 2025 Aug;191:105688.
参考文献
[1] Fernandez, ´ R., Chon, E., 2018. Comparison of two melphalan protocols and evaluation of outcome and prognostic factors in multiple myeloma in dogs. J. Vet. Intern. Med. 32, 1060–1069.
[2] Romanelli, P., Recordati, C., Rigamonti, P., Bertazzolo, W., 2022. Erythrophagocytic multiple myeloma in a dog. J. Vet. Diagn. Invest. 34, 718–722.
[3] Teddy, L., Sylvester, S.R., O’Connor, K.S., Hume, K.R., 2023. Cyclical 10-day dosing of melphalan for canine multiple myeloma. Vet. Comp. Oncol. 21, 533–540.
[4] Valente, P.C.L.G., Peleteiro, M.C., Dias, M.J., Vicente, G., Pomba, C., Duarte, A., Correia, J., 2024. Multiple myeloma in dogs: use of the cell block technique as a new diagnostic tool. Vet. Clin. Pathol. 53, 93–98.
[5] Wachowiak, I.J., Moore, A.R., Avery, A., Magunda, F., Harris, A., Laurence, H., Fulkerson, C.M., Fulkerson, C.V., Messick, J.B., Strandberg, N.J., McGrath, S., 2022. Atypical multiple myeloma in 3 young dogs. Vet. Pathol. 59, 787–791.
[6] Rusbridge, C., Wheeler, S.J., Lamb, C.R., Page, R.L., Carmichael, S., Brearley, M.J., Bjornson, A.P., 1999. Vertebral plasma cell tumors in 8 dogs. J. Vet. Intern. Med. 13, 126–133.
[7] Wyatt, S., De Risio, L., Driver, C., Jos´e-Lopez, ´ R., Pivetta, M., Beltran, E., 2019. Neurological signs and MRI findings in 12 dogs with multiple myeloma. Vet. Radiol. Ultrasound 60, 409–415.
[8] Leriquier, C., Benoit-Biancamano, M.-O., Lacoste, H., Herndon, G.D., 2017. Hemangiosarcoma within an intermuscular lipoma in a golden retriever dog. Can. Vet. J. 58, 1105–1109.
[9] Kimura, S., Yamazaki, M., Tomohisa, M., Mori, T., Yanai, T., Maeda, S., Kamishina, H., 2018. Infiltrative lipoma causing vertebral deformation and spinal cord compression in a dog. J. Vet. Med. Sci. 80, 1901–1904.
[10] Munoz, A., Riber, C., Satue, K., Trigo, P., Gomez-Diez, M., Castejo, F.M., 2013. Multiple myeloma in horses, dogs and cats: A comparative review focused on clinical signs and pathogenesis. In: Multiple Myeloma – A Quick Reflection on the Fast Progress. InTech.
[11] Kim, J., Kim, K., Oh, D., Myung, H., Choi, J., Yoon, J., 2023. Postoperative computed tomographic assessment of the complete resection of an infiltrative lipoma compressing the spinal cord in a dog. Vet. Sci. 10, 593.
[12] Bulte, C.A., Hoegler, K.M., Khachemoune, A., 2020. Collision tumors: a review of their types, pathogenesis, and diagnostic challenges. Dermatol. Ther. 33.
[13] Ribeiro, A.M.B., Borin, A.S., de Mello, G.D.R., Chojniak, R., 2024. Bone metastasis from renal cancer coinciding with the same anatomical position as a vertebral hemangioma: a collision lesion case report. World J. Nucl. Med. 23, 135–140.
[14] Jakab, C., Szasz, ´ A., Kulka, J., Schaff, Z., Rusvai, M., N´emeth, T., G´ alfi, P., 2009. Cutaneous mast cell tumor within a lipoma in a boxer. Acta Vet. Hung. 57, 263–274.
[15] Matus, R.E., Leifer, C.E., MacEwen, E.G., Hurvitz, A.I., 1986. Prognostic factors for multiple myeloma in the dog. J. Am. Vet. Med. Assoc. 188, 1288–1292.