
| 一般情况 | |
 | 品种:拉布拉多猎犬 |
| 年龄:6岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肺炎 | |
01 主诉及病史
有慢性肺炎和咳嗽病史,因急性咳嗽就诊。
根据临床体征和放射学检查被诊断患有肺炎。最近的治疗包括抗生素(头孢他啶,30 mg/kg,PO、恩诺沙星,10 mg/kg,PO,q24h或氨苄西林/舒巴坦,30 mg/kg,IV)、补充氧气和类固醇。
02 检查
体重23 kg。血液检查显示明显的白细胞减少(1.78 K/μL [5.05-16.76])、中性粒细胞减少(0.16 K/μL [2.95-11.64])、淋巴细胞减少(1.03 K/μL [1.05-5.10])、嗜酸性粒细胞减少(0.01 K/μL [0.06-1.23])、轻度血小板减少(138 K/μL [148-484])、碱性磷酸酶轻度升高(222 U/L [23-212])、淀粉酶轻度降低(417 U/L [500-1500])和轻度低氯血症(108 mmol/L [109-122])。
胸部X光片显示左头肺叶实变,右中肺叶和右头肺叶出现肺泡模式。
体格检查显示精神迟钝和轻度脱水,毛细血管再充盈时间为3秒。不发热(38.8°C),心率120 bpm,呼吸60 bpm,SpO2为97%。右前胸听诊可闻及刺耳的支气管水泡音,并注意到咯血。存在高乳酸血症(3.19 mmol/L [0.5-2.0])。
CT显示左胸尾部区域有轻度气胸、轻度纵隔气肿和轻度胸腔积液。右头、中、左尾肺叶和头肺叶存在软组织混浊的异质性增加、许多矿化病灶和空气潴留。细胞学样本来自肺实质和胸腔积液。诊断为脓胸和严重的脓性肉芽肿性肺炎。
03 治疗
第二天接受了全麻以进行开胸探查术。用芬太尼(100 μg,IV)预先给药,利多卡因(44 mg,IV)、氯胺酮(50 mg,IV)和咪达唑仑(5 mg,IV)诱导。异氟醚、芬太尼(10 μg/kg/h)、利多卡因(2 mg/kg/h)、氯胺酮(1 mg/kg/h)和丙泊酚(0.2 mg/kg/min)维持麻醉。
正中胸骨切开术显示左头肺叶和右中肺叶完全实变。使用胸腹V3吻合器在靠近肺门的地方分开右头肺叶,进行了右头肺叶切除术。为了维持肺活量,没有切除左头肺叶。
放置一根12 Fr胸腔闭式插管,并用20号环扎丝以8字形闭合胸骨切开处。其余组织常规闭合。麻醉恢复顺利。
在重症监护病房接受支持性护理,包括芬太尼(2-4 μg/kg/h)、氯胺酮(2 mg/kg/h)、乳酸林格氏液(2 mL/kg/h)和16 mEq/L氯化钾以及2 L/min鼻氧补充,还有氨苄西林/舒巴坦(30 mg/kg,IV,q8h)和恩诺沙星(10 mg/kg,IV,q24h)。住院期间每6h用0.9%生理盐水雾化。
手术后2天,胸腔闭式引流管移位后出现张力性气胸。进行了间歇性胸腔穿刺术至术后5天,由于胸腔积液持续积聚,放置了新的胸腔闭式插管。
手术后6天,胸骨切开处切口裂开。胸部X光片证实左头肺叶持续实变。胸腔积液和切口裂开部位的细胞学显示存在细胞内和细胞外球菌和杆菌。
手术后8天,CT显示左头肺叶持续实变,左头肺叶前部碎裂,提示肺叶脆性。与之前的CT相比,左尾肺叶没有明显变化。还观察到以左侧为主的气胸伴轻度纵隔气胸。进行了第二次正中胸骨切开术,完成了左头肺叶切除术。手术部位清创,切除大部分坏死组织。常规关闭胸骨,并放置了新的胸腔闭式引流管。
第一次手术后10天(第二次手术后2天),发现切口有明显的脓性分泌物,伤口再次裂开,以及新的、可听见的漏气。将连续胸腔引流系统连接到胸腔闭式插管以排出胸腔中的空气。从切口引流中获得的样本培养和药敏结果显示存在多重耐药大肠杆菌。
第一次手术后11天(第二次手术后3天),进行了第三次正中胸骨切开术。皮肤切口裂开,胸骨切开部位出现坏死,有明显的炎症(下图)。
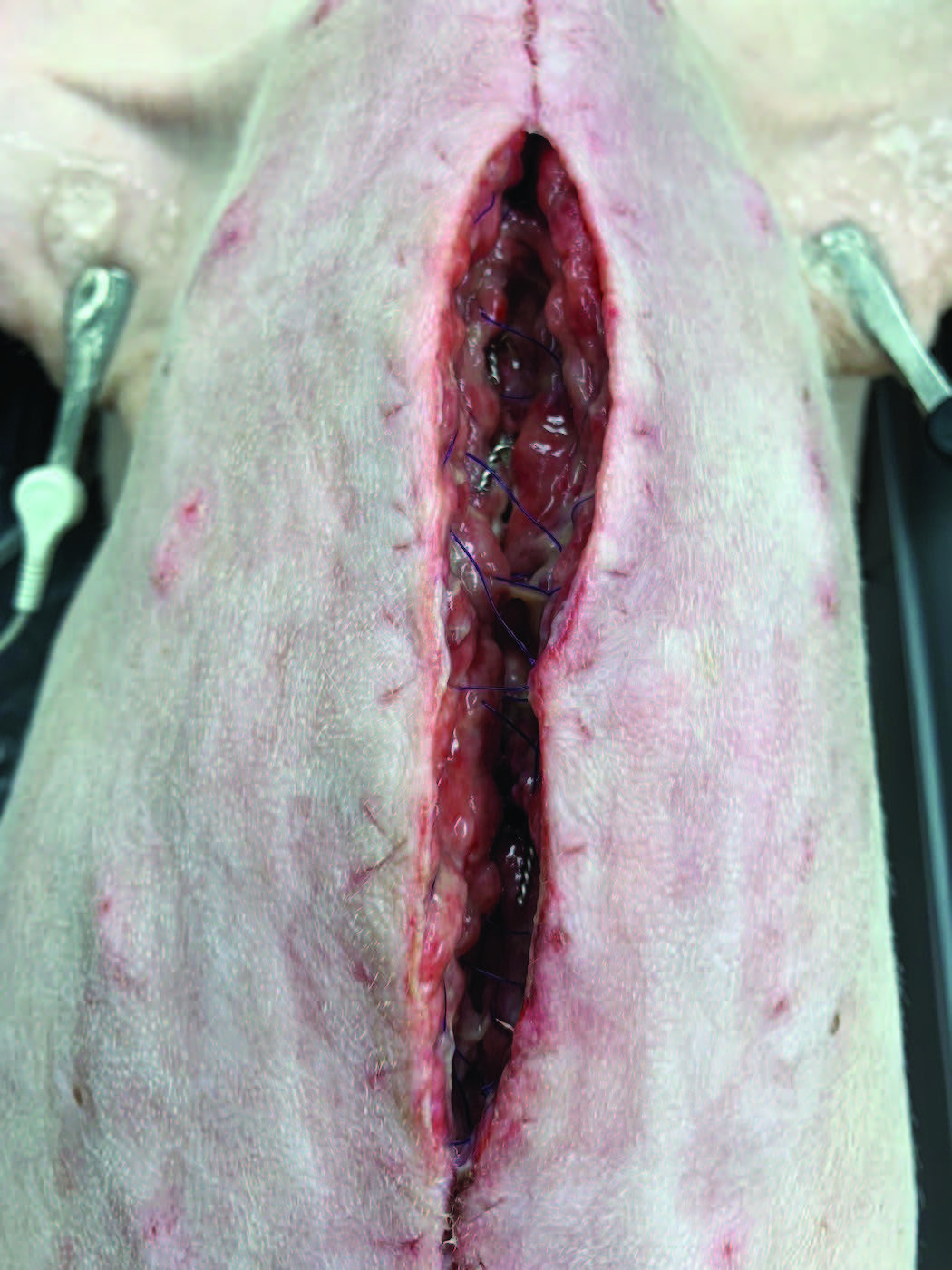
↑ 照片显示了部分裂开的切口,在去除正中胸骨切开术上的绷带和皮肤缝合线后很明显。周围组织坏死,手术缝线暴露。
胸骨尾部的两处骨折存在于环扎线水平(下图)。有轻度浆液血性胸腔积液、中度胸膜炎和纵隔炎症伴明显的纵隔粘连。其余肺部大致正常,在正压通气胸腔灌洗期间未观察到肺部漏气。一根24 Fr胸腔闭式插管根据需要每4-8小时进行一次放置和间歇性排空。胸骨切开术用20号环扎线和2-0缝线部分闭合。坏死组织被切除。
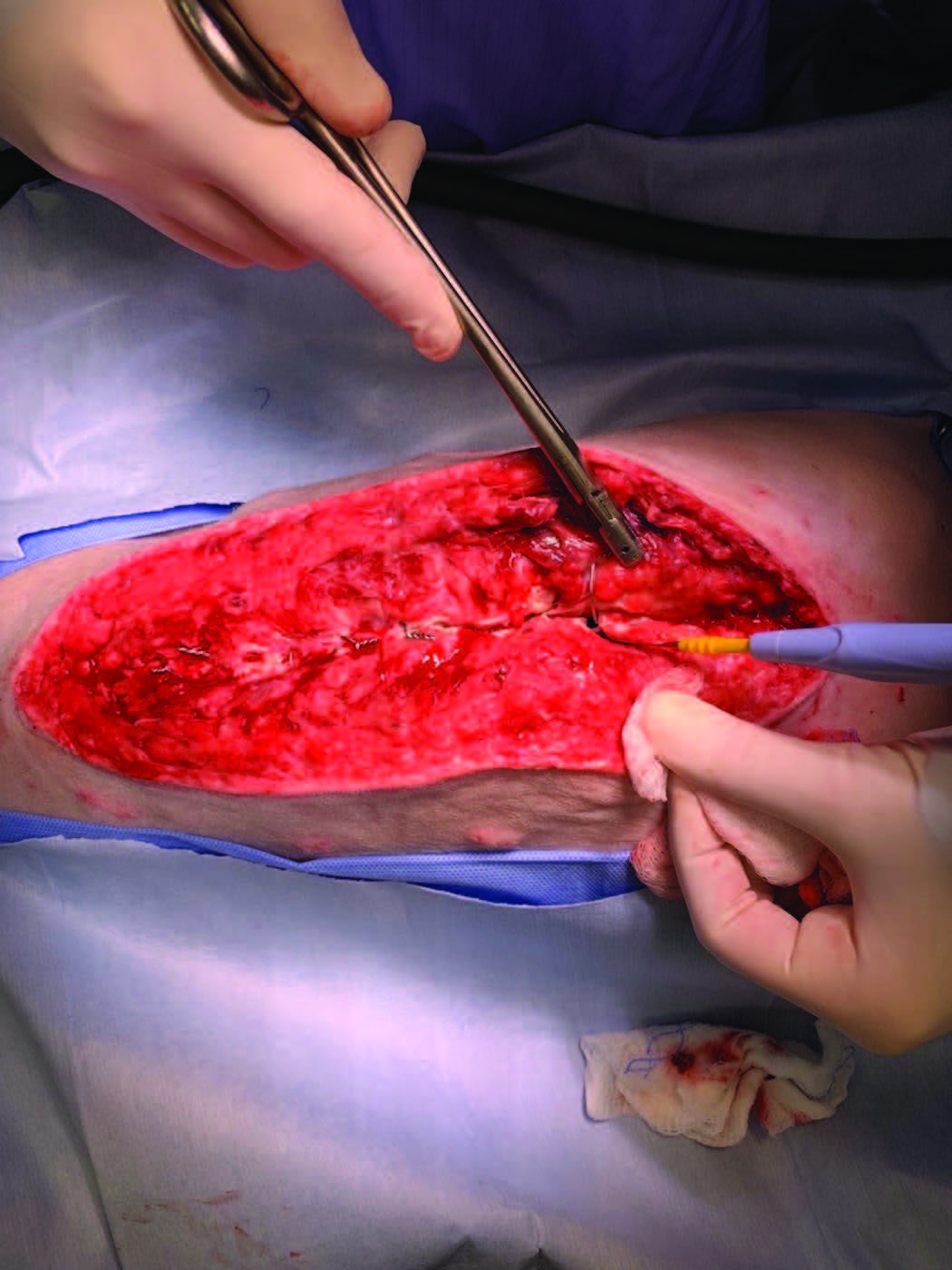
↑ 照片显示环扎线横切了胸骨并导致尾部胸骨骨折(由电烙尖端指示)。
负压伤口治疗(NPWT)以-50 mmHg的压力应用于部分闭合的胸骨切开部位(下图)。
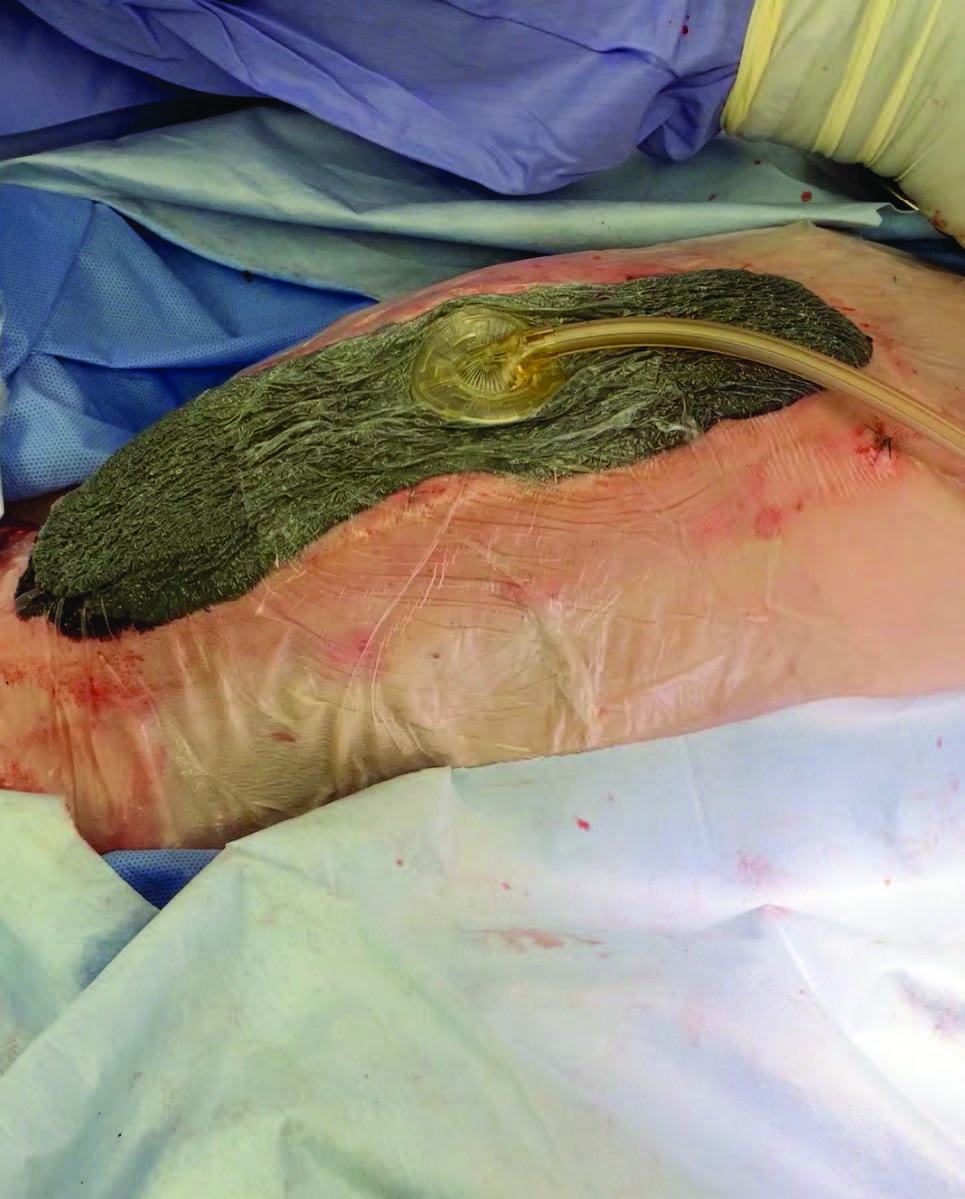
↑ 照片显示负压伤口疗法应用于部分闭合的胸骨切开部位。
麻醉恢复后送往重症监护室,给予芬太尼(2-4 μg/kg/h)、羟乙基淀粉(0.6 mL/kg/h),16 mEq氯化钾(1.3 mL/kg/h)、哌拉西林和他唑巴坦(50 mg/kg,IV,q6h)、阿米卡星(20 mg/kg/天,IV,q24h)和卡洛芬(2.2 mg/kg,SC,q12h)。用0.9% NaCl雾化10 min q6h。
NPWT在前15小时内保持在-50 mmHg,在接下来的74小时内保持-75 mmHg(下图)。在整个NPWT期间,呼吸频率保持在30-40 bpm之间,室内空气的SpO2为98%-99%,全身血压为120-150 mmHg。
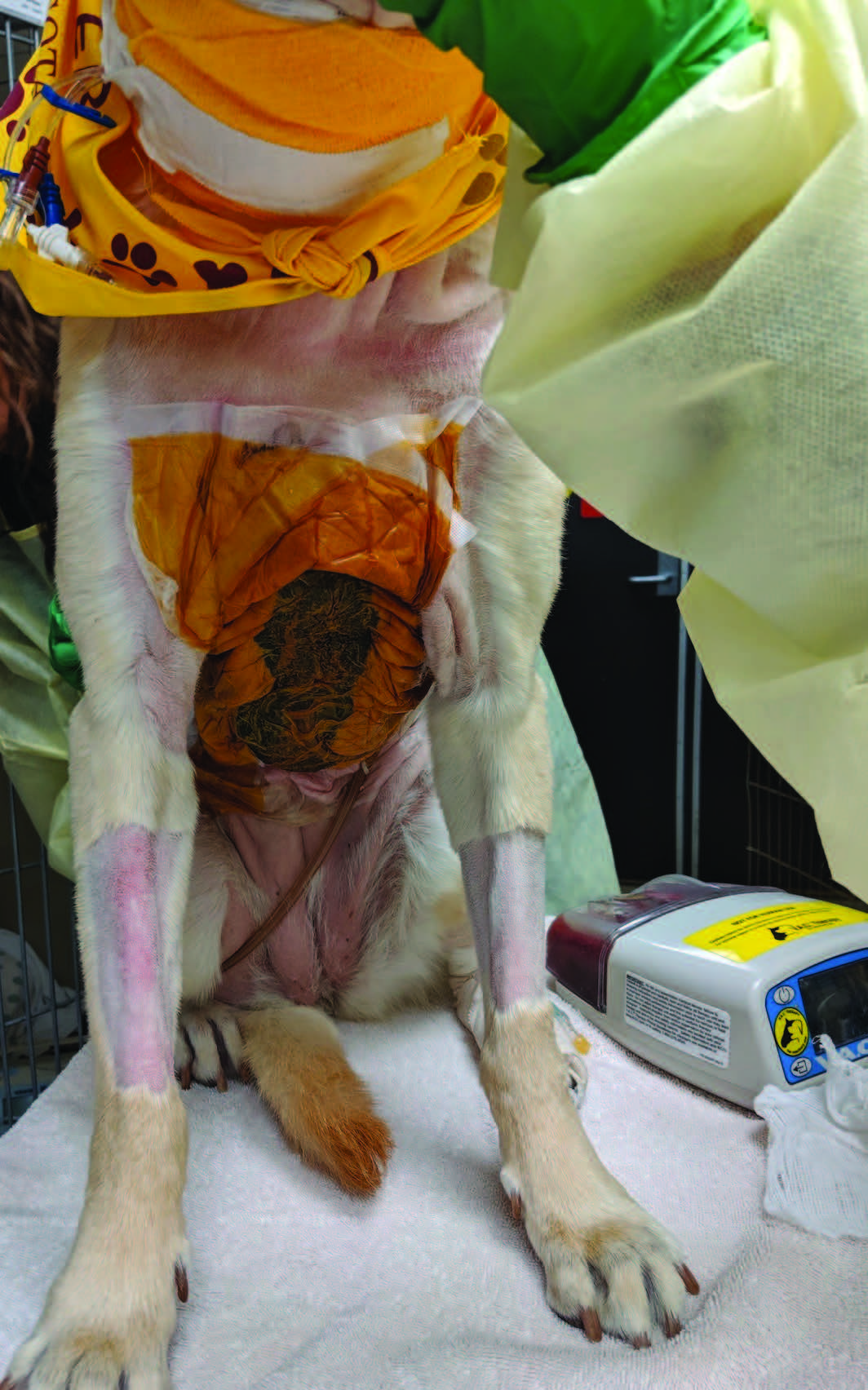
↑ 在重症监护病房中,负压伤口治疗。
肺叶(右中、右头肺叶和左头肺叶)的组织病理学评估显示严重的坏死性出血性、纤维蛋白性和中性粒细胞性肺炎,没有明确的细菌微生物。
04 预后
轻度外周水肿,NPWT第1天出现低白蛋白血症(1.5 g/dL [2.7-3.7])和低蛋白血症(4.3 g/dL [5.0-6.9]),在住院期间逐渐改善,无需干预。
- 第1天胸腔闭式引流管和NPWT分别为3.2 mL/kg/天和315 g/d。
- 第2天胸腔闭式引流管和NPWT分别为2.3 mL/kg/天和130 g/d。
- 第3天胸腔闭式引流管和NPWT分别为0.56 mL/kg/天和450 g/d。
- 第4天胸腔闭式引流管和NPWT分别为0.9 mL/kg/天和405 g/d。
对一块胸骨进行培养和药敏试验,发现粪肠球菌和大肠埃希菌感染,这些细菌对氯霉素敏感。大肠埃希菌对甲氧苄啶/磺胺甲噁唑、阿米卡星、庆大霉素和亚胺培南敏感。
NPWT第4天,全麻以去除NPWT。去除NPWT后,该部位肉芽组织明显,无坏死组织。以常规方式闭合皮下组织和皮肤。NPWT移除后胸腔引流管保持在原位,在接下来的48小时内引流量逐渐减少,从每天4.86 mL/kg减少到每天0.86 mL/kg。床旁超声证实胸膜腔内没有明显的积液。出院前的胸部X光片显示间质混浊降低,第3和第4胸骨可见轻度不规则增生,第4胸骨尾侧可见轻度异质透光。
去除NPWT后第3天,拔除胸腔引流管,出院并开具甲氧苄啶/磺胺甲噁唑(15 mg/kg,PO,q12h)、加巴喷丁(10 mg/kg,PO,q8h)和可待因(2 mg/kg,PO,q8h)。
在后续检查中,表现出间歇性喘息和咳嗽,并在随后的2个月内消退。
出院后1个月,胸部X线显示第3和第4胸骨裂解和第6胸骨腹侧骨膜增生的轻度松解。未观察到局灶性间质或肺泡模式,但存在全身支气管模式。
出院后4个月,X光片显示受影响的胸骨混浊增加和平滑边缘骨质增生,表明骨髓炎有所改善。未发现肺炎的证据。
05 讨论
负压伤口疗法(NPWT)是一种对伤口施加连续或间歇真空压力的技术,通过刺激新肉芽组织的发育来促进引流和伤口愈合。该技术主要用于帮助皮肤伤口或移植物的闭合和愈合,特别是感染伤口或裂开风险高的伤口[1-14]。
NPWT也被用于治疗人类患者的胸部和腹膜感染[15-20]。尽管有关于使用NPWT去除感染性腹膜炎狗和猫的炎性渗出物的报告[8,11],但使用NPWT协助胸腔引流的文献数量有限。
NPWT已被用于有开放性伤口、脱套损伤、坏死性筋膜炎、皮瓣、皮肤移植物、胸部咬伤或感染性腹膜炎的狗和猫[1,2,5,6]。NPWT用于开胸术的最佳负压尚未在狗中进行评估。-125 mmHg的NPWT通常用于狗的开放性伤口处理,而对于全层皮肤移植物,可以考虑-45至-65 mmHg之间的较低压力范围[3,12]。
在成年人类患者中,-125 mmHg的压力用于治疗胸腔内和深部胸部伤口感染,没有负面的血流动力学影响[21,22]。然而,在应用了NPWT的开放性胸部伤口的狗的报告中,肺顺应性在-125 mmHg的压力下下降,需要调整到-100 mmHg[23]。
在人类儿科患者中,通常使用-50至-100 mmHg之间的NPWT,因为担心儿童的组织可能比成人组织更脆弱,并且更容易受到施加更高压力导致的循环变化的影响[20]。对儿科胸骨切开术后NPWT的研究发现,-50 mmHg的压力足以控制感染,最大限度地减少并发症,并在不手术胸骨闭合的情况下实现胸骨稳定[20,24,25]。
在具有开放正中胸骨切开术的猪模型中,当NPWT为-75 mmHg时,心输出量、呼气末CO2浓度、平均动脉压和平均肺压不受影响[26]。根据这些信息,本例中NPWT的初始压力在前50小时内设置为-15 mmHg。术后没有明显的血流动力学变化,因此,NPWT增加到-75 mmHg以进一步促进伤口愈合。没有证据表明在整个NPWT期间血流动力学受到影响。
一些作者建议根据其他参数确定NPWT中使用的特定压力,例如患者体重[15,27]或伤口的经皮血氧饱和度值[28]。目前,没有报道的单一压力设置被认为适合所有患者和伤口类型,并且必须根据伤口类型和渗出液量进行调整。
总之,NPWT在-75 mmHg的压力下可安全应用,并且似乎有助于感染多重耐药细菌的部分闭合胸骨切开术的狗的愈合。下面的心肺结构没有明显的损伤,狗的通气和血流动力学状态没有受到影响。
文献来源:Arai S, Coryell J, Johnson T, Chow RS, Amsellem PM. Application of negative pressure wound therapy to partially closed median sternotomy in a dog. Can Vet J. 2025 Jan;66(1):51-57.
参考文献
1.Hattersley R. Degloving injuries in companion animals. Companion Anim. 2019;24:68–76.
2.Mastrocco A, Prittie J. Early and aggressive surgical debridement and negative pressure wound therapy to treat necrotizing fasciitis in three dogs. Vet Surg. 2021;50:1662–1669.
3.Stanley BJ, Pitt KA, Weder CD, et al. Effects of negative pressure wound therapy on healing of free full-thickness skin grafts in dogs. Vet Surg. 2013;42:511–522.
4.Demaria M, Stanley BJ, Hauptman JG, et al. Effects of negative pressure wound therapy on healing of open wounds in dogs. Vet Surg. 2011;40:658–669.
5.Miller AJ, Cashmore RG, Marchevsky AM, et al. Negative pressure wound therapy using a portable single-use device for free skin grafts on the distal extremity in seven dogs. Aust Vet J. 2016;94:309–316.
6.Or M, Goethem BV, Kitshoff A, et al. Negative pressure wound therapy using polyvinyl alcohol foam to bolster full-thickness mesh skin grafts in dogs. Vet Surg. 2017;46:389–395.
7.Pitt KA, Stanley BJ. Negative pressure wound therapy: Experience in 45 dogs. Vet Surg. 2014;43:380–387.
8.Cioffi KM, Schmiedt CW, Cornell KK, Radlinsky MG. Retrospective evaluation of vacuum-assisted peritoneal drainage for the treatment of septic peritonitis in dogs and cats: 8 cases (2003–2010) J Vet Emerg Crit Care. 2012;22:601–609.
9.Bertran J, Farrell M, Fitzpatrick N. Successful wound healing over exposed metal implants using vacuum-assisted wound closure in a dog. J Small Anim Pract. 2013;54:381–385.
10.Kirkby KA, Wheeler JL, Farese JP, et al. Surgical views — Vacuum-assisted wound closure: Clinical applications. Compend Contin Educ Vet. 2010;32:E1–E6.
11.Buote NJ, Havig ME. The use of vacuum-assisted closure in the management of septic peritonitis in six dogs. J Am Anim Hosp Assoc. 2012;48:164–171.
12.Ben-Amotz R, Lanz OI, Miller JM, Filipowicz DE. The use of vacuum-assisted closure therapy for the treatment of distal extremity wounds in 15 dogs. Vet Surg. 2007;36:684–690.
13.Bristow PC, Perry KL, Halfacree ZJ, Lipscomb VJ. Use of vacuum-assisted closure to maintain viability of a skin flap in a dog. J Am Vet Med Assoc. 2013;243:863–868.
14.Owen L, Hotston-Moore A, Holt P. Vacuum-assisted wound closure following urine-induced skin and thigh muscle necrosis in a cat. Vet Comp Orthop Traumatol. 2009;22:417–421.
15.Sherman G, Shulman-Manor O, Dagan O, et al. Vacuum-assisted closure for the treatment of deep sternal wound infection after pediatric cardiac surgery. Pediatr Crit Care Med. 2020;21:150–155.
16.Martino AD, Re FD, Falcetta G, et al. Sternal wound complications: Results of routine use of negative pressure wound therapy. Braz J Cardiovasc Surg. 2020;35:50–57.
17.Ivanzov S, Soynov I, Kulyabin Y, et al. Vacuum-assisted closure versus closed irrigation for deep sternal wound infection treatment in infants: A propensity score-matched study. Interact Cardiovasc Thorac Surg. 2019;29:776–782.
18.de Jesus LE, Martins AB, Oliveira PB, et al. Negative pressure wound therapy in pediatric surgery: How and when to use. J Pediatr Surg. 2018;53:585–591.
19.Sziklavari Z, Ried M, Hofmann HS. Vacuum-assisted closure therapy in the management of lung abscess. J Cardiothorac Surg. 2014;9:157.
20.Kawajiri H, Aeba R, Takaki H, et al. Negative pressure therapy for post-sternotomy wound infections in young children. Interact Cardiovasc Thorac Surg. 2014;19:102–106.
21.Aru GM, Jew NB, Tribble CG, Merrill WH. Intrathoracic vacuum-assisted management of persistent and infected pleural spaces. Ann Thorac Surg. 2010;90:266–270.
22.Groetzner J, Holzer M, Stockhausen D, et al. Intrathoracic application of vacuum wound therapy following thoracic surgery. Thorac Cardiovasc Surg. 2009;57:417–420.
23.Nolff MC, Pieper K, Meyer-Lindenberg A. Treatment of a perforating thoracic bite wound in a dog with negative pressure wound therapy. J Am Vet Med Assoc. 2016;249:794–800.
24.Salazard B, Niddam J, Ghez O, et al. Vacuum-assisted closure in the treatment of poststernotomy mediastinitis in the paediatric patient. J Plast Reconstr Aesthet Surg. 2008;61:302–305.
25.Kadohama T, Akasaka N, Nagamine A, et al. Vacuum-assisted closure for pediatric post-sternotomy mediastinitis: Are low negative pressures sufficient? Ann Thorac Surg. 2008;85:1094–1096.
26.Mokhtari A, Gustafsson R, Sjögren J, et al. Haemodynamic effects of −75 mmHg negative pressure therapy in a porcine sternotomy wound model. Int Wound J. 2009;6:48–54.
27.Fleck T, Fleck M. Negative pressure wound therapy for the treatment of sternal wound infections after cardiac surgery. Int Wound J. 2014;11:240–245.
28.Meloni M, Izzo V, Vainieri E, et al. Management of negative pressure wound therapy in the treatment of diabetic foot ulcers. World J Orthop. 2015;6:387–393.