
| 一般情况 | |
 | 品种:德国牧羊犬 |
| 年龄:4岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:维生素K缺乏 | |
01 主诉及病史
因1年来的食欲减退、间歇性呕吐和慢性腹泻被转诊。过去2天内,出现了口腔出血。
已完成全部疫苗接种,并接受了体外和体内抗寄生虫治疗。没有接触有毒物质的情况。正在食用一种高消化性的商业犬粮。
02 检查
就诊时精神萎靡,严重消瘦,体况评分仅为1/9分。黏膜苍白,毛细血管再充盈时间延长,牙龈出血。心率正常(144次/分),股动脉搏动可触及。收缩压133 mmHg。体温37.2°C。腹部触诊时有不适感。其余体格检查未见异常。
血常规的主要发现为中度再生性贫血和轻度血小板减少(表1,D1)。
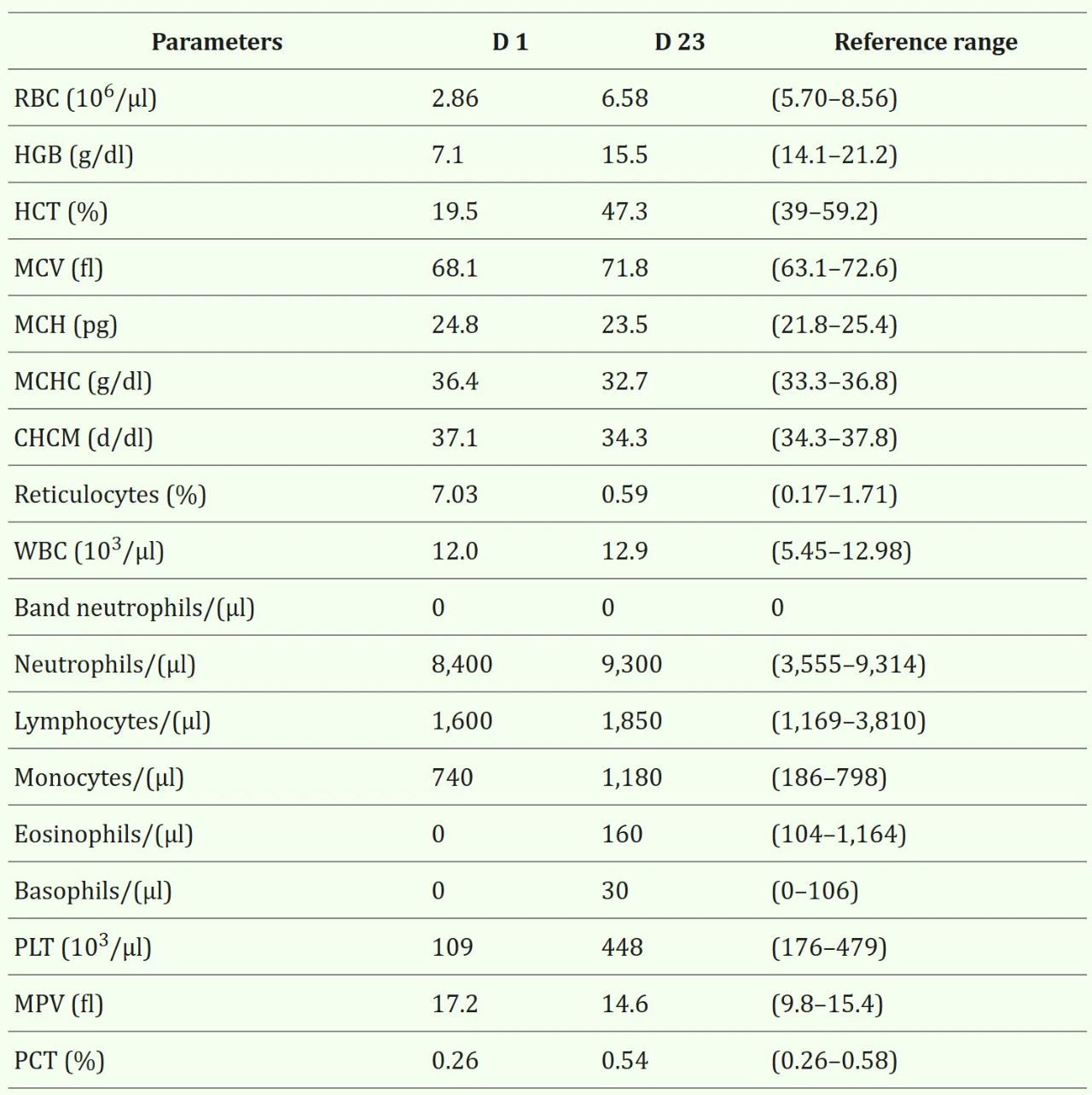
↑ 表1. 就诊第1天及第23天的血细胞总数。
血生化显示丙氨酸氨基转移酶轻度升高、轻度全蛋白血症、中度低胆固醇血症及血清乳酸轻度升高(表2,D1)。
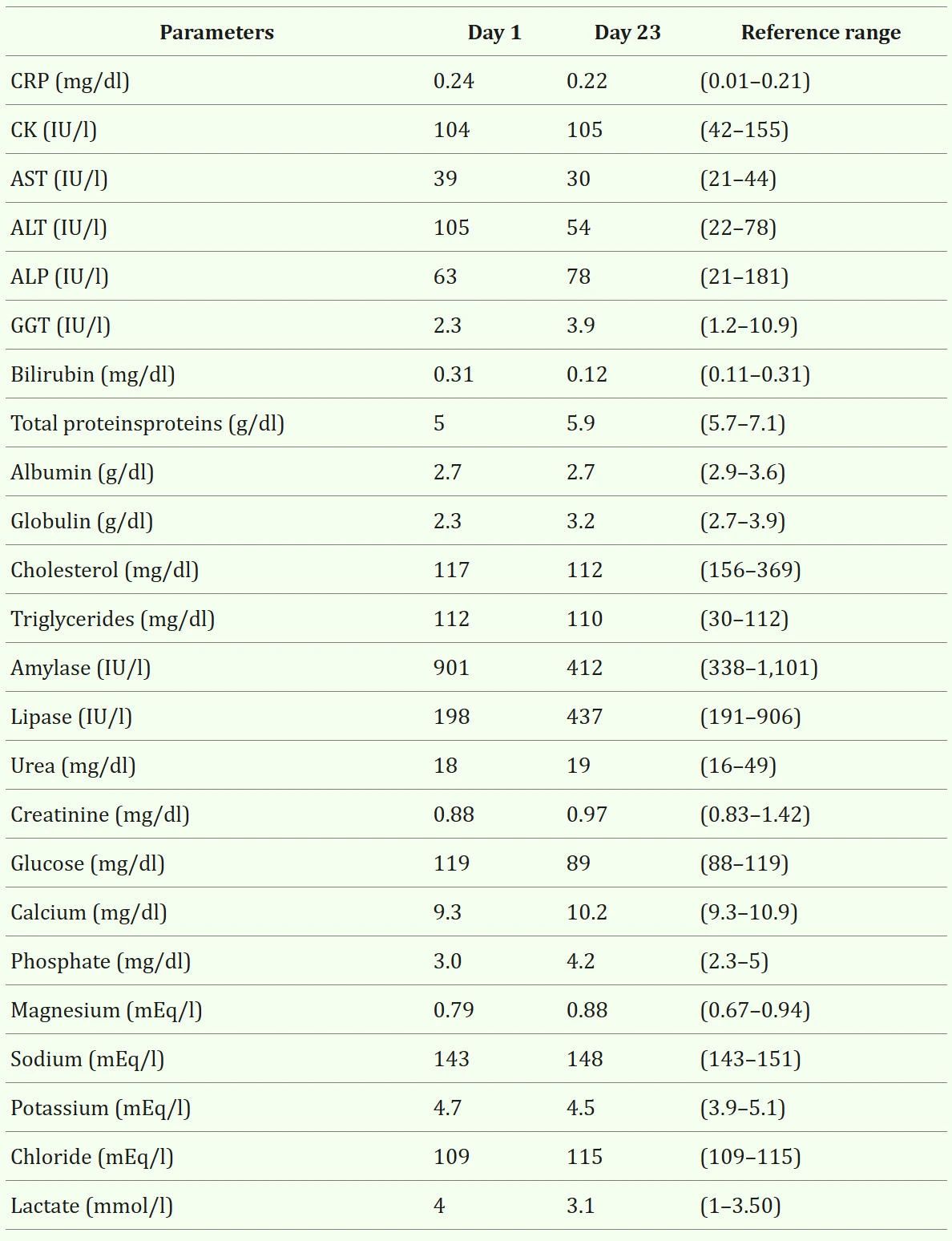
↑ 表2. 就诊第1天及第23天的血生化指标。
鉴于血小板减少程度无法解释口腔出血,进行了凝血功能检测。结果显示凝血酶原时间(PT)和活化部分凝血活酶时间(aPTT)均显著延长(表3,D1)。
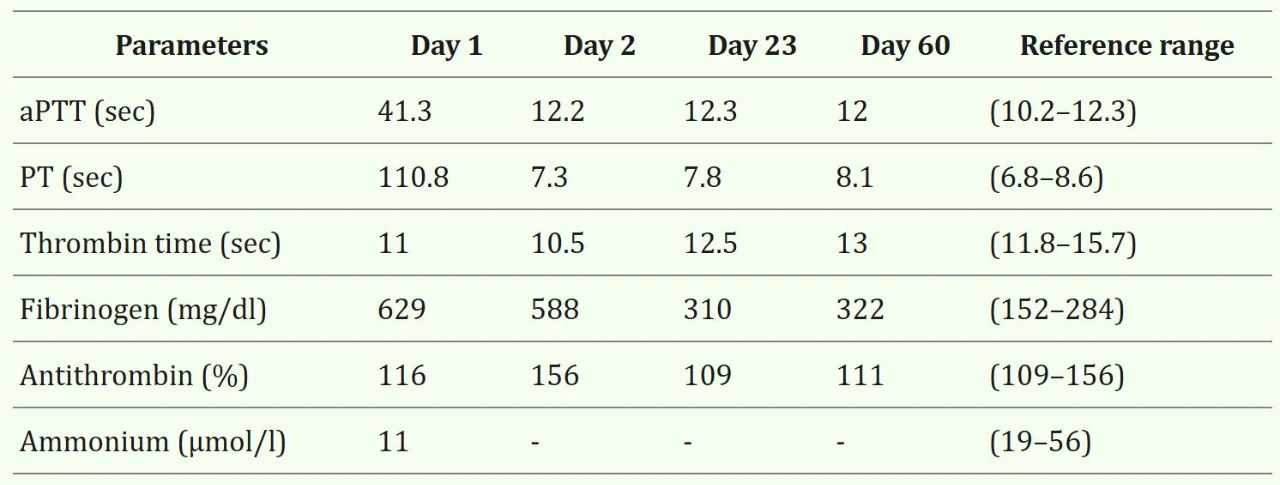
↑ 表3. 入院第1天、第2天、第23天和第60天的凝血功能检查结果及血氨水平。
初始稳定化措施包括静脉注射维生素K1(5 mg/kg一次),随后口服2.5 mg/kg q12h,同时因早期休克征象与凝血障碍并存而进行全血输注(15 ml/kg)。
对抗凝剂杀鼠剂和香豆素类药物进行了毒理学筛查,结果为阴性,排除了因摄入维生素K1拮抗剂导致的获得性凝血障碍。
维生素K1给药24小时后重复检测PT和aPTT,均恢复正常,且未再观察到口腔出血。此时,考虑为维生素K1缺乏。基于慢性胃肠道症状、体重减轻以及低胆固醇血症和泛低蛋白血症,肠道吸收不良被认为是维生素K1缺乏的最可能原因。
犬胰蛋白酶样免疫反应性正常(24 µg/l [5.2–35]),排除了胰腺功能不全。低钴胺血症(100 ng/l [290–611])进一步支持肠道吸收不良的诊断,尽管血清叶酸正常(5.6 µg/l [3.0–15])。粪便样本未检测到寄生虫。
腹部超声显示轻度非特异性肠病征象(下图)。未发现其他异常。
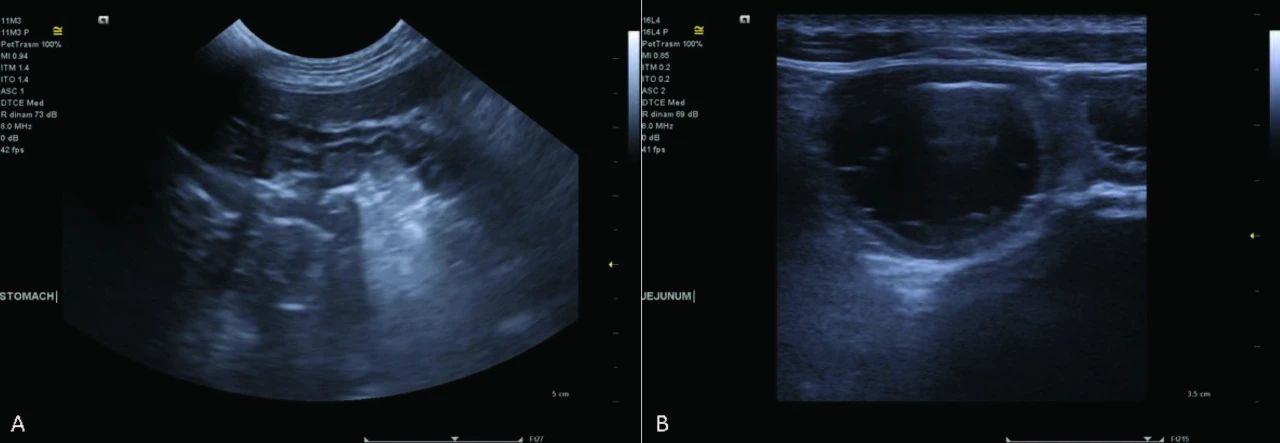
↑ 胃部因气体充盈而轻度膨胀。胃壁黏膜下层增厚(A)。观察到多个充满液体的空肠襻;肠壁异常包括黏膜层轻度变薄及高回声(B)。
03 治疗
开始皮下注射氰钴胺(1500微克,每周一次,持续6周)。住院3天后,出院时给予维生素K1(2.5 mg/kg)口服,每日两次、益生菌(每日一次,每次一包),以及水解商业犬粮。
04 预后
出院后20天,仍有腹泻和体重减轻。血常规显示贫血已缓解,但存在中度血小板增多(表1,D23),生化显示持续低白蛋白血症和低胆固醇血症(表2,D23)。凝血功能正常(表3,D23)。因此,维生素K1补充治疗被停止。
腹部超声未见显著变化。鉴于临床症状未见改善,进行了消化道内镜检查并取多处活检样本。病理学诊断为慢性淋巴细胞-浆细胞性胃炎和肠炎,十二指肠活检中还观察到淋巴管中度扩张(下图)。开始使用泼尼松龙进行免疫抑制治疗,剂量为每日一次,每次2 mg/kg。
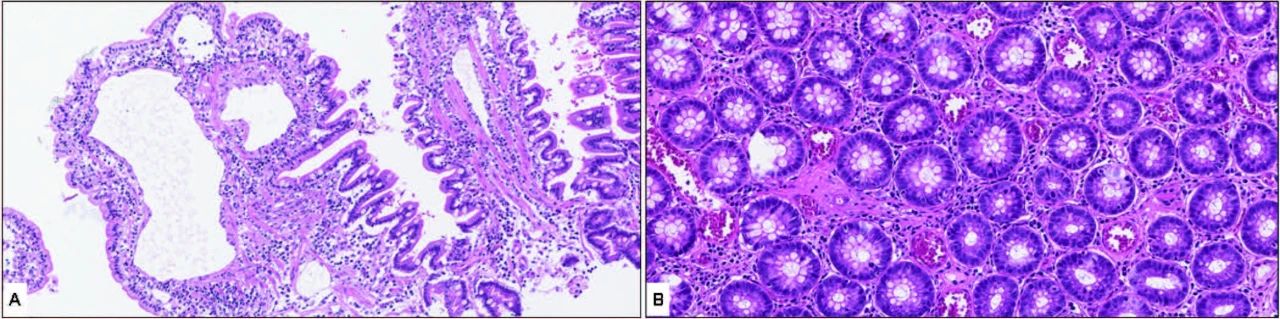
↑ 十二指肠活检标本的HE染色显示,绒毛顶端呈多灶性融合,其中部分绒毛顶端呈钝圆形,且略微至中度缩短。淋巴管呈现不同程度的扩张,从轻度/中度到偶尔严重。固有层特征为小成熟淋巴细胞和浆细胞数量中度增加,以及浸润性嗜酸性粒细胞数量轻度增加。伴有中度且多灶性融合的间质水肿(A)。结肠活检标本的HE染色显示,固有层以淋巴细胞、浆细胞及多灶性浸润中性粒细胞的轻度至中度增加为特征。罕见情况下,隐窝呈现扩张的腔隙,内含脱落细胞、弱嗜酸性物质及少量中性粒细胞。伴有多灶性间质水肿。观察到表层上皮的多灶性糜烂(B)。
接下来的4周内,未观察到进一步的胃肠道或出血症状,体重有所增加。
治疗8周后,开始逐渐减少泼尼松龙的用量,减少至每天口服1.5 mg/kg。然而,出现了腹泻和体重减轻的复发,促使启动了第二次免疫抑制治疗,使用环孢素(5 mg/kg,q12h)。尽管胃肠道症状未得到控制,但未出现临床出血复发或凝血时间延长(表3,D60)。
接下来的6个月内,尽管进行了多次饮食干预、免疫抑制治疗调整及粪便移植,病情仍未改善。最终被安乐死。
05 讨论
维生素是一类在代谢过程中需要少量参与的生物化学性质各异的有机化合物。维生素可分为水溶性维生素和脂溶性维生素,而维生素K属于后者。维生素K主要有两种形式:叶绿醌(维生素K1),主要存在于植物中,尤其是绿叶蔬菜中;以及甲萘醌(维生素K2),主要由某些肠道细菌产生,尽管在动物性食物中也含有少量。
肠道中存在多种兼性或专性厌氧细菌,包括大肠杆菌、脆弱拟杆菌、迟缓埃格特菌和乳酸乳球菌,这些细菌负责产生各种甲萘醌亚型。因此,肠道微生物群的紊乱,如菌群失调,可能对这些化合物的产生产生不利影响。
作为脂溶性化合物,肝胆系统、胰腺和肠道的正常功能对维生素K的有效吸收至关重要。当摄入时,维生素K1与蛋白质结合,这些蛋白质在小肠中被胰酶分解。无论是食物中的游离维生素K1还是肠道细菌产生的维生素K2,均在胆汁盐的帮助下溶解成微粒。这些微粒随后被肠上皮细胞吸收,整合入乳糜微粒,并通过淋巴系统直接运送到肝脏。
维生素K在维持凝血平衡中发挥关键作用。维生素K的羟基喹啉形式作为γ-谷氨酰羧化酶的辅因子,催化参与凝血过程的多种蛋白质中谷氨酸残基的γ-羧化反应。
这些蛋白质包括凝血因子II、VII、IX和X,以及蛋白质C、S和Z,它们被转化为活性形式。该反应还需分子氧和二氧化碳参与,每发生一次谷氨酸残基的羧基化反应,就会生成一个维生素K环氧化物分子。因此,维生素K缺乏主要与凝血功能障碍及出血倾向增加相关。
本病例中氨基转移酶水平的初始升高可能提示肝病是维生素K缺乏的原因。然而,缺乏提示肝功能障碍的实验室检查结果(如高胆红素血症和高氨血症)以及正常的纤维蛋白原血清水平削弱了这一假设。当然,进行血清胆汁酸刺激试验本可以更确信地排除肝功能不全,但该试验未被执行。
肝外胆道阻塞引起的胆汁淤积性疾病是另一种由于吸收不良导致维生素K缺乏的机制。然而,基于临床表现、实验室检查(如血清胆红素正常)及影像学结果,本例患者与该关联的可能性被认为较低。此外,先前研究显示,部分或完全性肝外胆道梗阻的犬只未出现凝血酶原时间(PT)或活化部分凝血活酶时间(aPTT)延长,提示维生素K吸收充足。
在本病例中,导致口腔出血的维生素K缺乏被归因于肠道吸收不良,其原因可能是肠炎。此外,患者的缺乏状态可能与肠道微生物群紊乱相关的多种情况复杂化,例如产生甲萘醌的细菌数量减少以及消耗维生素K的微生物过度生长。
维生素K缺乏引起的自发性出血虽罕见,但已被充分记录为人类(尤其是婴儿)肠道吸收不良的并发症。人类研究表明,影响膳食脂肪吸收的疾病,如肠道淋巴管扩张症和慢性炎症性肠病,可能导致脂溶性维生素缺乏。
类似发现近期在患有慢性肠病犬中也有报道,尽管未特指维生素K。由于维生素K是脂溶性维生素,其缺乏在这些病例中可被预期。然而,这一问题尚未被专门研究。
蛋白质丢失性肠病犬的低凝血状态可能与肠道吸收不良导致的维生素K缺乏有关。此外,作者未发现有关肠道吸收不良犬出血事件发生率的研究,而在现有兽医文献中,这一并发症仅在两例因淋巴细胞浆细胞性肠炎导致吸收不良综合征的猫中被报道。
尽管PT和aPTT延长而纤维蛋白原浓度正常可能提示维生素K缺乏,但它们并非诊断维生素K缺乏的可靠生物标志物。这是因为这些凝血时间仅测量肝脏用于合成凝血因子的维生素K。剩余的维生素K用于骨代谢。
在人类中,已知维生素K缺乏首先影响骨代谢,随后才导致凝血问题。因此,PT升高并引发出血事件必须伴随显著的维生素K缺乏。这可能解释了为何人类中出血事件罕见报告,甚至在小型动物中也常被忽视。
在本例中,患者在补充维生素K1后未再出现出血事件,且在患者复查时也未检测到出血事件。尽管停止了维生素K1补充且胃肠道症状持续存在,后续凝血试验中未观察到异常凝血时间。这可能表明口服维生素K1的给药可能在凝血因子再次缺乏前,使体内储存量在较长时间内得到补充。
总之,本病例提示,对于所有存在肠道吸收不良的动物,均应考虑维生素K治疗,尤其是在检测到异常凝血或在进行与出血风险相关的操作前。
文献来源:Marceglia G, Petini M. Vitamin K deficiency as a cause of oral bleeding in a dog with intestinal malabsorption due to lymphocytic-plasmacytic enteritis. Open Vet J. 2025 May;15(5):2277-2282.