
| 一般情况 | |
 | 品种:斯皮茨犬 |
| 年龄:12岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:卵巢性腺母细胞瘤和无性细胞瘤、乳腺间变性癌和复杂癌 | |
01 主诉及病史
因右腹股沟和左后腹乳腺出现可触及的肿块而就诊。
从未交配过,发情周期没有异常。14个月前的超声显示卵巢大小正常,左右卵巢分别为1.7×1.2×1 cm和1.3×1×0.9 cm。
02 检查
血液学和血生化检查显示轻微贫血。
超声显示左侧卵巢有一个轮廓分明、实心、异质和高回声占位,具有不规则的低回声囊和轻度血流,尺寸4.73×4.5×4.33 cm(下图)。右侧卵巢增大,具有多个符合滤泡囊肿的圆形结构。
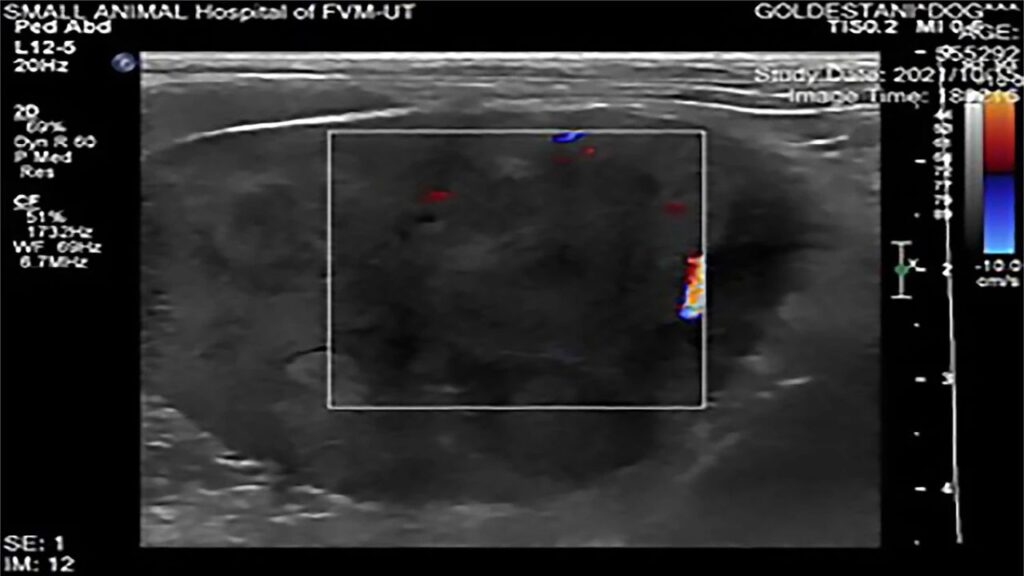
03 治疗
进行了卵巢子宫切除术和双侧分期根治性乳房切除术。
对左侧卵巢的宏观检查显示,组织有包裹、不规则、乳白色、光滑、实心且坚硬,表面略呈凸起状,有灰黑色病灶。在切割时偶尔会遇到柔软易碎的病灶,以及深色变色(下图)。
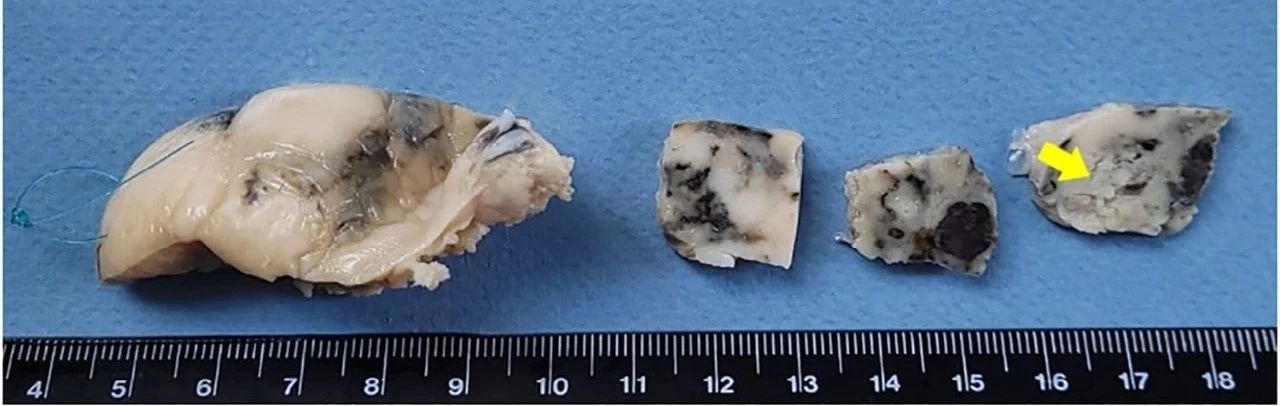
↑ 左侧卵巢GB随机切片的外视图和切割面,具有软化和易碎区域(黄色箭头)。
从子宫、双卵巢和乳腺组织中获得代表性切片。在组织病理学上,左侧卵巢组织完全被肿瘤细胞取代。该肿块由两个不同的肿瘤实体组成:①类似于人类性腺母细胞瘤(GB)的肿瘤和②无性细胞瘤,后者在体积上占主导地位。
GB包括经典变体和解剖变体(下图ab)。前者由离散的圆形和椭圆形巢以及生殖细胞岛组成,这些岛被以冠状排列的性索基质元素紧密包围。每个巢/岛在外部都被基底膜材料的透明化沉积物包围(下图c)。解剖变体小得多,并合并到无性细胞瘤成分中,表现为扩张性、不规则或绳状图案,保留基底膜沉积物(下图bd)。
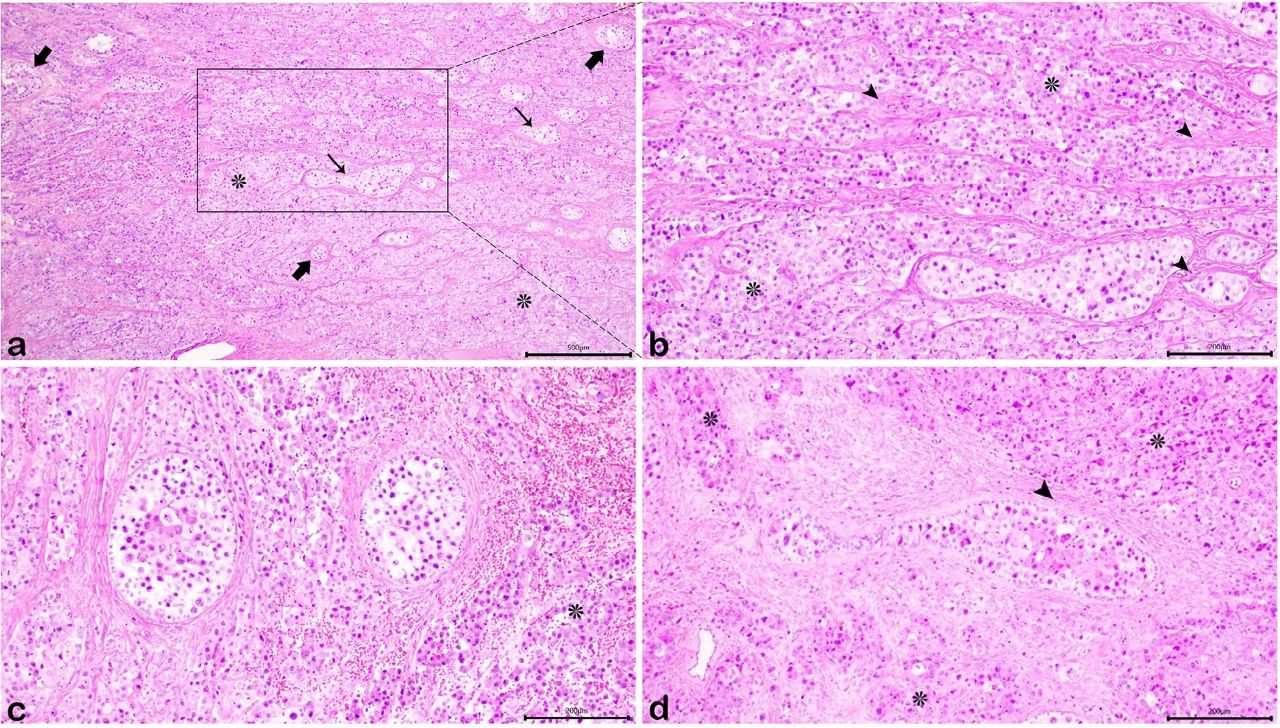
↑(a)GB与无性细胞瘤(星号)混合。描绘了GB的经典(粗箭头)和解剖(细箭头)变体,(b)解剖变体、基底膜材料(箭头)的透明化和增厚沉积物以及无性细胞瘤成分(星号)显而易见,(c)经典GB的圆形或椭圆形巢,包括生发细胞的中央聚集体,这些生发细胞被具有小而圆形细胞核的性索基质细胞紧密包围,还描绘了无性细胞瘤成分(星号),(d)解剖变体被视为杠铃形结构,具有与经典变体相似的细胞成分,周围环绕着增厚的基底膜(箭头)。还存在无性细胞瘤细胞(星号)。
GB的生殖细胞成分表现为大肿瘤细胞,具有细胞多形性和丰富的空泡细胞质,以及大囊泡核,有丝分裂罕见,偶尔多核形成(下图ef)。无性细胞瘤由最小的基质和密集的、大的、圆形的和多形性肿瘤细胞组成,具有丰富的两亲性至嗜酸性细胞质、囊泡核和突出的核仁。还注意到许多非典型的有丝分裂象、多灶性淋巴细胞浸润、多核形成和瘤内出血(下图gh)。
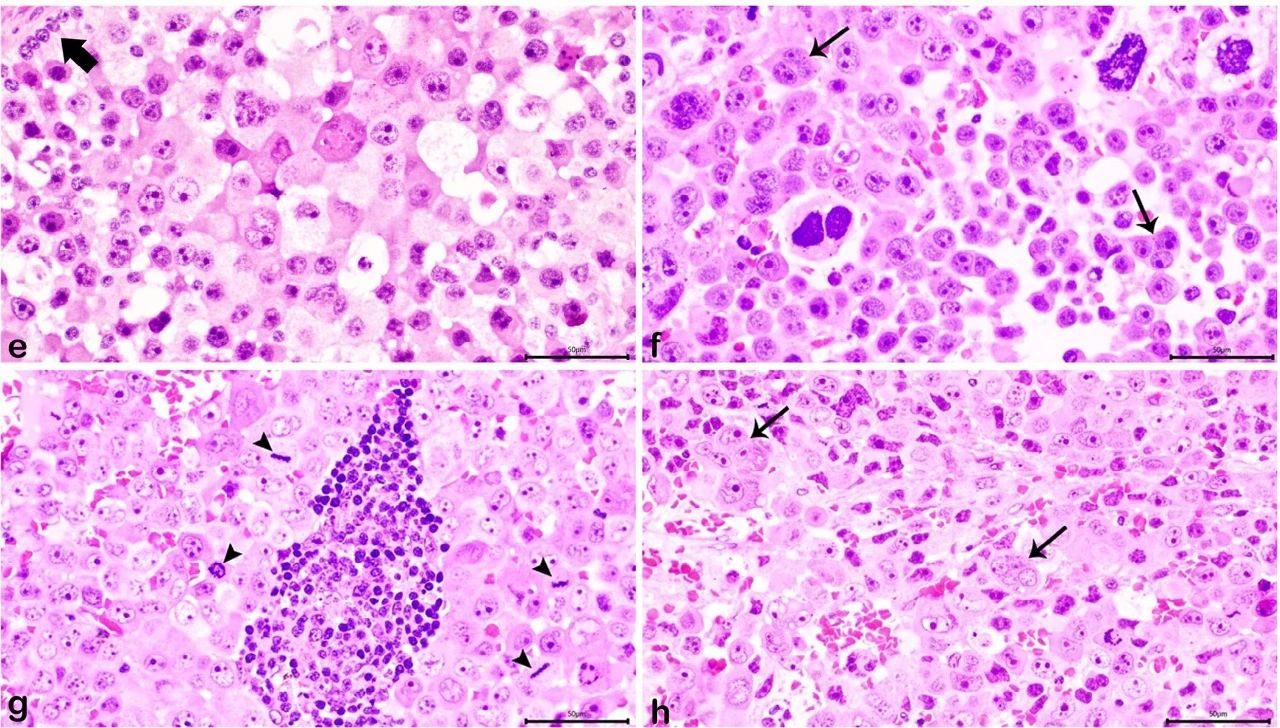
↑(e-f)GB的生殖细胞成分。大肿瘤细胞的多形性和多核形成(细箭头)。细胞具有丰富的细胞质和大的囊泡核。还描绘了性索基质细胞(粗箭头)和(g-h)无性细胞瘤表现出明显的多形性、多核形成(细箭头)、淋巴细胞浸润、有丝分裂活性(箭头)和瘤内出血。
GB和无性细胞瘤的生殖细胞对c-kit均呈阴性,但对SALL4表现出很强的弥漫性核免疫反应(下图a)。大多数生殖细胞对OCT-4表现出轻度至中度的细胞质和核染色(下图b)。与无性细胞瘤相比,GB内的生殖细胞尤其表现出异质的OCT-4表达。一些生殖细胞,尤其是GB成分的生殖细胞,对E-钙粘蛋白表现出弱至中度的免疫反应(下图c)。性索基质元素弥漫性免疫标记为α抑制素(下图d),而只有40%的细胞角蛋白AE1 / AE3呈阳性(下图e)。性索基质细胞和生殖细胞对WT-1具有免疫反应性,尽管生殖细胞显示出较弱的核染色(下图f)。波形蛋白在所有细胞中均呈弥漫阳性(下图g)。Ki67指数为30%(下图h)。
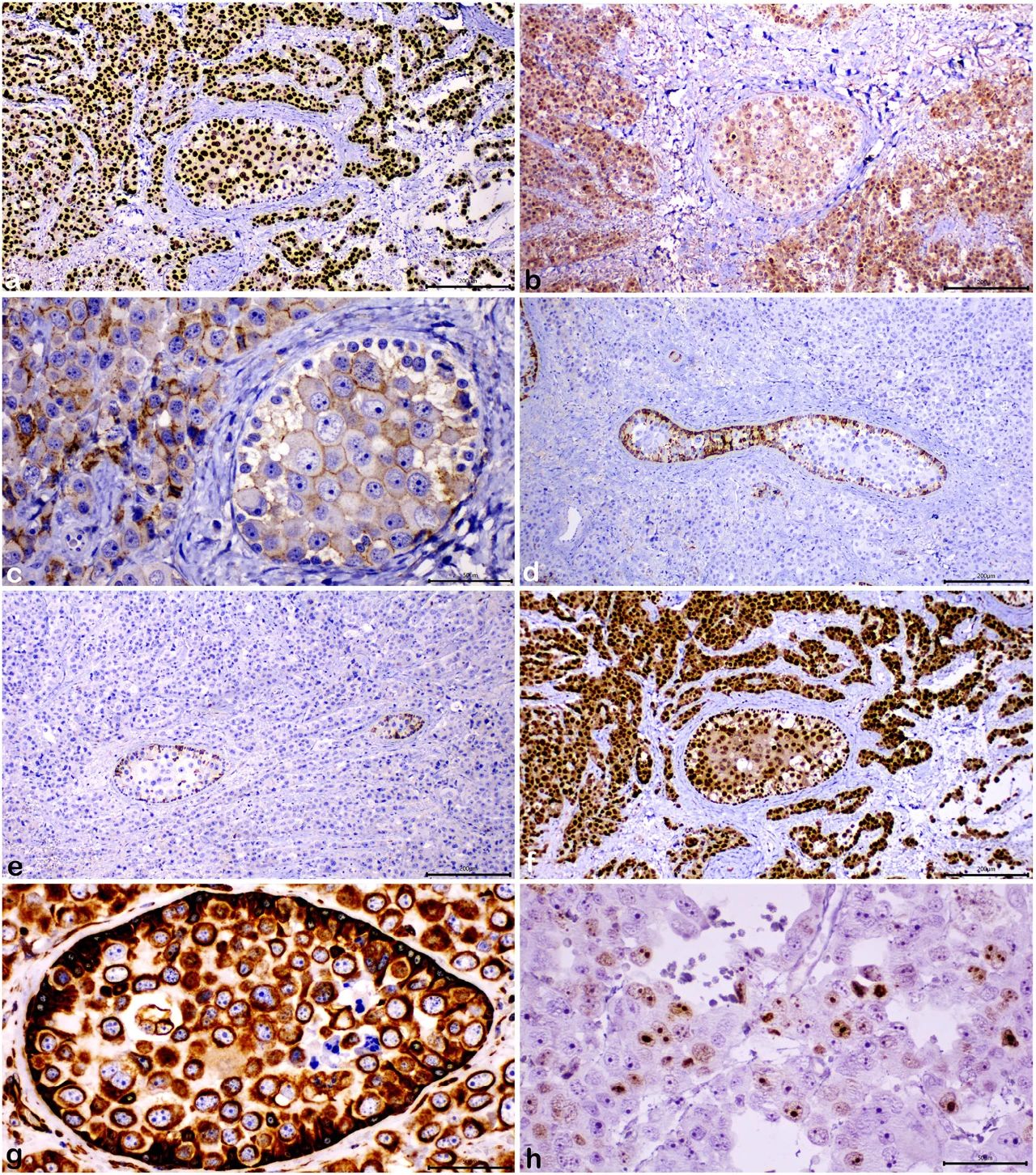
↑(a)GB和无性细胞瘤的生发成分对SALL4表现出很强的弥漫性免疫反应,(b)在生殖细胞中观察到OCT-4的中度细胞质和核免疫染色,(c)生殖细胞对E-钙粘蛋白表现出弱至中度的膜免疫反应,(d)GB的性索基质元素对α-抑制素弥漫性免疫标记,(e)性索基质细胞对细胞角蛋白AE1/AE3的免疫反应性很明显,(f)性索基质细胞和生殖细胞都对WT-1表现出免疫反应,(g)在生发和性索基质元素中都注意到波形蛋白的弥漫性免疫染色,(h)在大约30%的肿瘤细胞中注意到Ki67免疫标记。
对乳腺进行了显微镜检查。右腹股沟乳腺受III级间变性癌影响,其中高度恶性和个体化上皮细胞具有极端的多形性、血管生成以及基质和淋巴浸润。在左后腹乳腺中,良性肌上皮增生以及浸润性恶性上皮成分表明I级复杂癌。其他腺体受到增生和发育不良过程的影响。
评估乳腺肿瘤的细胞角蛋白AE1/AE3和P63免疫组化标志物。间变性癌和复杂癌的上皮成分均表达细胞质对细胞角蛋白AE1/AE3的免疫反应性。P63的核免疫标记在复杂癌内的肌上皮细胞中很明显。免疫组织化学组合结合组织病理学特征证实了初步诊断(下图a-d)。
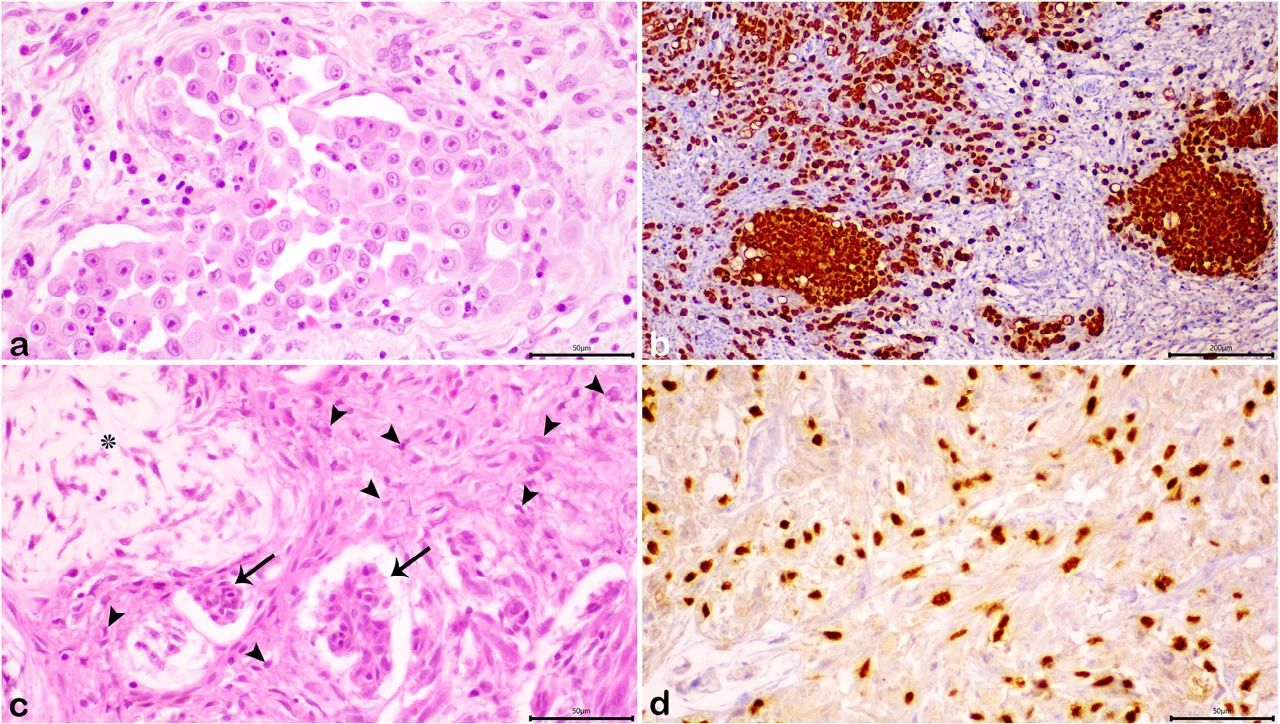
↑(a)间变性癌。恶性和多形性个体化上皮细胞的淋巴浸润,(b)间变性癌。肿瘤上皮成分显示细胞角蛋白AE1/AE3的强且弥漫的细胞质标记,(c)复杂癌。肌上皮细胞(箭头)的良性增殖与粘液样基质沉积(星号)和恶性上皮成分(细箭头)的存在,(d)在复杂癌的良性增殖肌上皮细胞中可见P63的核免疫标记。
从福尔马林固定的卵巢肿瘤、子宫和腹膜脂肪中提取DNA。根据哺乳动物染色体上都存在的牙釉蛋白(AMEL)基因的长度多态性来研究Y染色体的存在与否,用于性别鉴定。结果未检测到Y染色体。
04 预后
每次手术后,都顺利康复,术后并发症极少。
一个月后复发,出现间歇性跛行、腘窝淋巴结肿大和双后肢水肿。后肢和髋关节的放射学检查显示淋巴结肿大、软组织肿胀。胸腔影像学检查未见结节性转移病灶。遗憾的是,主人拒绝了进一步的检查和化疗。
最后一次手术后两个月,患者因临床恶化在当地诊所被安乐死。
05 讨论
伴侣犬的手术绝育在许多国家是被广泛接受的手术,这可能导致了犬卵巢肿瘤的罕见性,它们仅占犬肿瘤的0.5-1.2%。同样,卵巢切除术,尤其是在第一个发情周期之前,可以显著降低母犬乳腺肿瘤发展的可能性。
除了畸胎瘤,老年犬更容易患卵巢肿瘤。当卵巢的多个上皮细胞、生发细胞和性索基质细胞谱系发生肿瘤转化时,就会发生混合肿瘤。性腺母细胞瘤(Gonadoblastoma,GB)是最著名的卵巢混合肿瘤,由生殖细胞和性索基质元素的混合物组成。
GB是一种罕见的肿瘤,无论是在人类中,还是在动物中。尽管大多数GB往往是良性的,但如果不及时诊断,它们最终可能会变成恶性。此外,恶性生殖细胞群可能会使肿瘤过度生长并发展为生殖细胞瘤。GB是一种卵巢/睾丸混合肿瘤,几乎不可避免地在性发育障碍的人类中遇到。在医学上,它更常见于携带全部或部分Y染色体的表型女性(高达80%)。然而,遗传正常的女性和狗也患有这种肿瘤,一些患者在诊断时已经怀孕,一些患者有成功怀孕史。
推测不同的分子机制会在非发育不全的性腺中诱导GB。到目前为止,兽医文献中仅报道了7例GB病例:4只狗、2只家兔和1只小加拉戈兔。在所有报告的动物中,与雌性相比,雄性似乎受到的影响稍大(4/7)。左侧性腺更容易受到GB的影响。诊断时这些狗的年龄为10-17岁,平均年龄13岁。
精原细胞瘤和无性细胞瘤与GB的关联之前已分别在一只兔子和一只狗中报道过。同样,在本病例中也观察到了恶性生殖细胞瘤成分。据估计,这种同步性在人类中约为60%,与其他生殖细胞瘤相比,无性细胞瘤更常见。
GB,特别是解剖变体,可以通过性索基质细胞很容易与无性细胞瘤区分开。α抑制素免疫染色可用于检测性索基质成分并将这些细胞与浸润淋巴细胞区分开。无性细胞瘤本身必须与胚胎性癌相鉴别,特别是在具有高有丝分裂活性和核多形性的肿瘤中。细胞角蛋白AE1/AE3、HMWCK和E-钙粘蛋白是上皮标志物,用于精确排除胚胎性癌。
已经描述了GB的两种变体:经典变体和解剖变体。该分类基于细胞排列模式的差异。在组织病理学上,经典变体由离散的圆形至卵形岛和生殖细胞巢组成,与性索衍生物紧密混合,周围环绕着基底膜材料的透明化沉积物。解剖变体与经典GB具有相同的细胞组成,而细胞以不规则的模式排列,以固体/膨胀、吻合和绳状结构的形式出现。
在一名46岁、XX、23岁的女性中描述了解剖变体和经典变体的共存。在本案例中也注意到了这种关联,以前从未在动物身上描述过解剖GB。
总之,本报告描述了一例混合癌症患者的组织病理学和免疫组化特征以及AMEL基因的聚合酶链反应分析。GB的发展机制在核型正常的患者和遗传异常个体中可能有所不同。在本病例中,WT-1基因突变也可能在GB的发展中发挥作用。
文献来源:Golchin D, Sasani F, Farzad-Mohajeri S, Tovhidifar M, Ashrafi Tamai I. Co-Occurrence of Ovarian Dysgerminoma-Inducing Gonadoblastoma and Two Distinct Mammary Carcinomas in a Dog: A Case Report and Review of the Literature. Vet Med Sci. 2025 Jul;11(4):e70470.