
| 一般情况 | |
 | 品种:迷你贵宾犬 |
| 年龄:11岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:门静脉高压 | |
01 主诉及病史
3周的持续性腹水。
没有慢性病史、既往腹部手术史或肝功能障碍。主人称既往身体健康。
患者已由当地兽医诊所开具呋塞米(0.5 mg/kg BID)和螺内酯(1 mg/kg BID)7天。腹部穿刺术进行了两次,间隔1周,第一次抽出600 mL液体,第二次抽出400 mL液体。
02 检查
体重5公斤。体况评分5/9,触诊时腹胀无痛,轻度体温过高(39.5°C),脉搏正常(155次/分),伴有轻度左侧收缩期杂音,收缩压150 mmHg,呼吸急促(60次/分)。
血液学、电解质分析和血生化结果无异常。肝胆酶水平以及总胆红素、血尿素氮、总胆固醇、葡萄糖和白蛋白等肝功能标志物均正常。凝血试验除了D-二聚体浓度升高(1002.78 ng/mL [50-250])外,也无其他异常。
腹部X线和超声证实存在大量腹水。腹腔积液确定为非化脓性改良渗出液(总有核细胞计数0.96 k/μL,总蛋白3.5 g/dL)。
腹部X线显示肝肿大(下图A),超声显示浸润性/空泡性肝病、肝缘不规则、脾肿大和门静脉速度降低(5-6.6 cm/s)(下图B)。超声心动图提示轻度二尖瓣反流和B1期粘液瘤性二尖瓣疾病,左心房与主动脉之比为1.37,左心室舒张末期内径1.47。未观察到右心异常。
CT显示右内侧和外侧肝叶有微肝,其余肝叶有肝肿大,脾肿大(下图C)。没有发现门静脉血栓形成或分流到后腔静脉的证据。门静脉大小和肺静脉与主动脉之比(1.1)在参考范围内(下图D)。
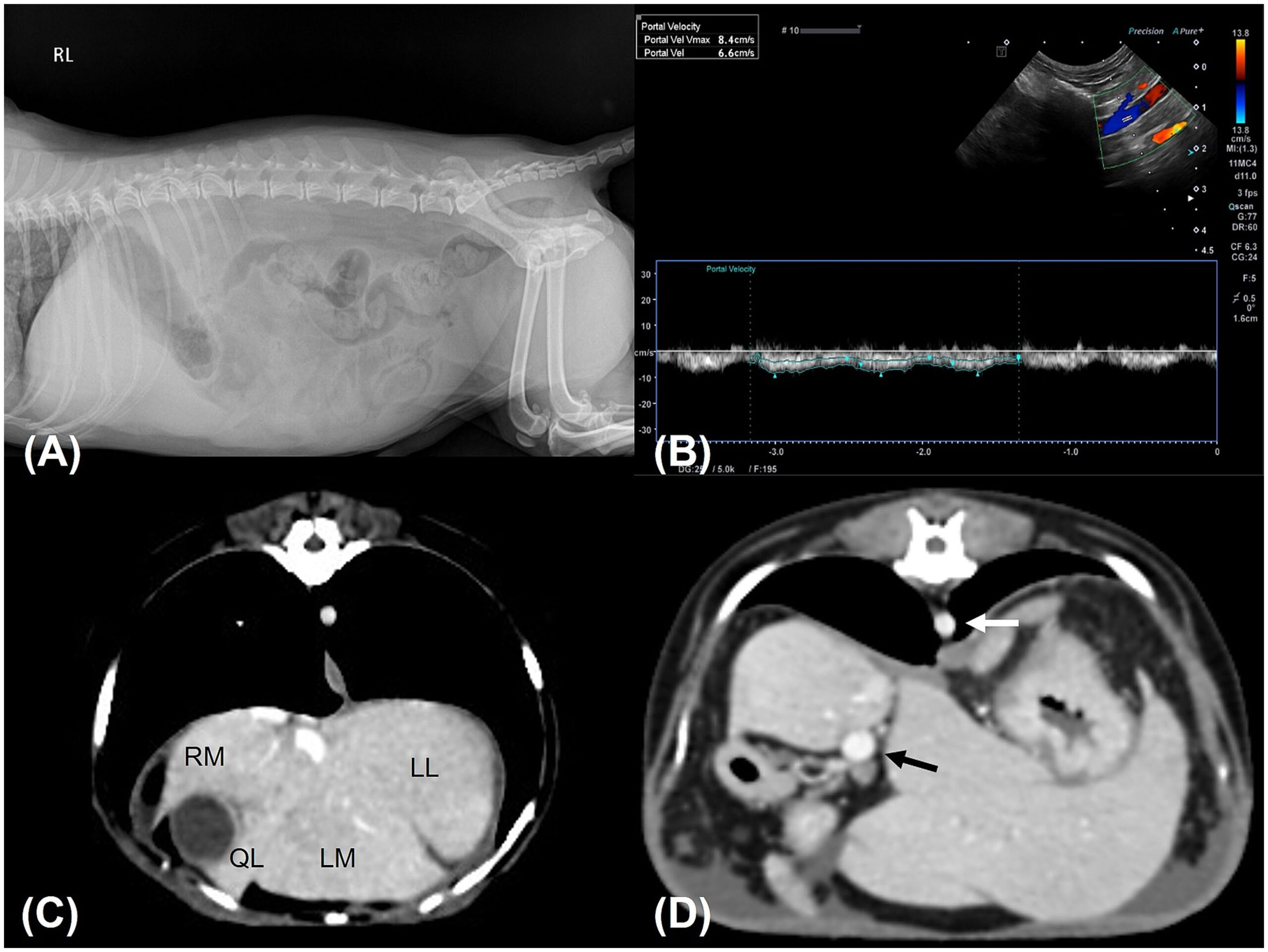
↑(A)右腹部X光片显示肝肿大并提示存在腹水。肝脏边缘呈圆形、钝,远超肋弓。观察到胃轴移位和浆膜细节减少。(B)门静脉腹部多普勒超声显示门静脉速度降低(6.6 cm/s)。(CD)横向CT扫描图像。(C)右肝叶的体积小于左肝叶。一些叶间空间似乎被腹水分隔。(D)门静脉直径(黑色箭头)与主动脉直径(白色箭头)的比值1.1,表明门静脉大小正常。RM;右内肝叶,LL;左外肝叶,LM;左内肝叶,QL:第四肝叶。
根据腹水、脾肿大和门静脉速度减慢的表现,诊断为门静脉高压(PH),通过影像学排除了PH的肝前和肝后性原因,确认了肝内性PH。
03 治疗
就诊当天,抽出腹水410 mL,体重下降至4.4 kg。腹水的治疗包括呋塞米(0.75 mg/kg BID)、螺内酯(1 mg/kg BID)和4天的钠限制饮食。
尽管采取了这些措施,但在就诊第4天仍抽出了400 mL腹水。门静脉速度保持在4.5 cm/s的较低水平,D-二聚体增加到2000 ng/mL [50-250]。呋塞米剂量增加至1 mg/kg BID,螺内酯剂量增加至1.5 mg/kg BID,持续19天。
尽管如此,在第10天和第18天再次抽出了350 mL腹水。为了明确PH的原因,计划进行肝活检、肝组织的细菌和真菌培养。考虑到脾肿大引起的血栓形成风险及其对门静脉血流动力学的潜在影响,还考虑进行脾切除术。
第23天,进行剖腹组织活检,检查脾脏等腹部器官。术前用药包括头孢唑啉(30 mg/kg IV)、法莫替丁(1 mg/kg IV)、马罗吡坦(1 mg/kg IV)、布托啡诺(0.1 mg/kg IV)和咪达唑仑(0.3 mg/kg IV)。用丙泊酚(6 mg/kg IV)诱导麻醉,随后进行插管,并用异氟醚(1.5-2.0%)氧气(0.25-0.5 L/min)维持麻醉。
无菌准备后,进行常规腹中线切开。进入腹腔后,持续抽吸去除约400 mL浅黄色透明腹腔积液。剖腹探查术显示脾脏肿大,边缘不规则,有充血迹象(下图)。
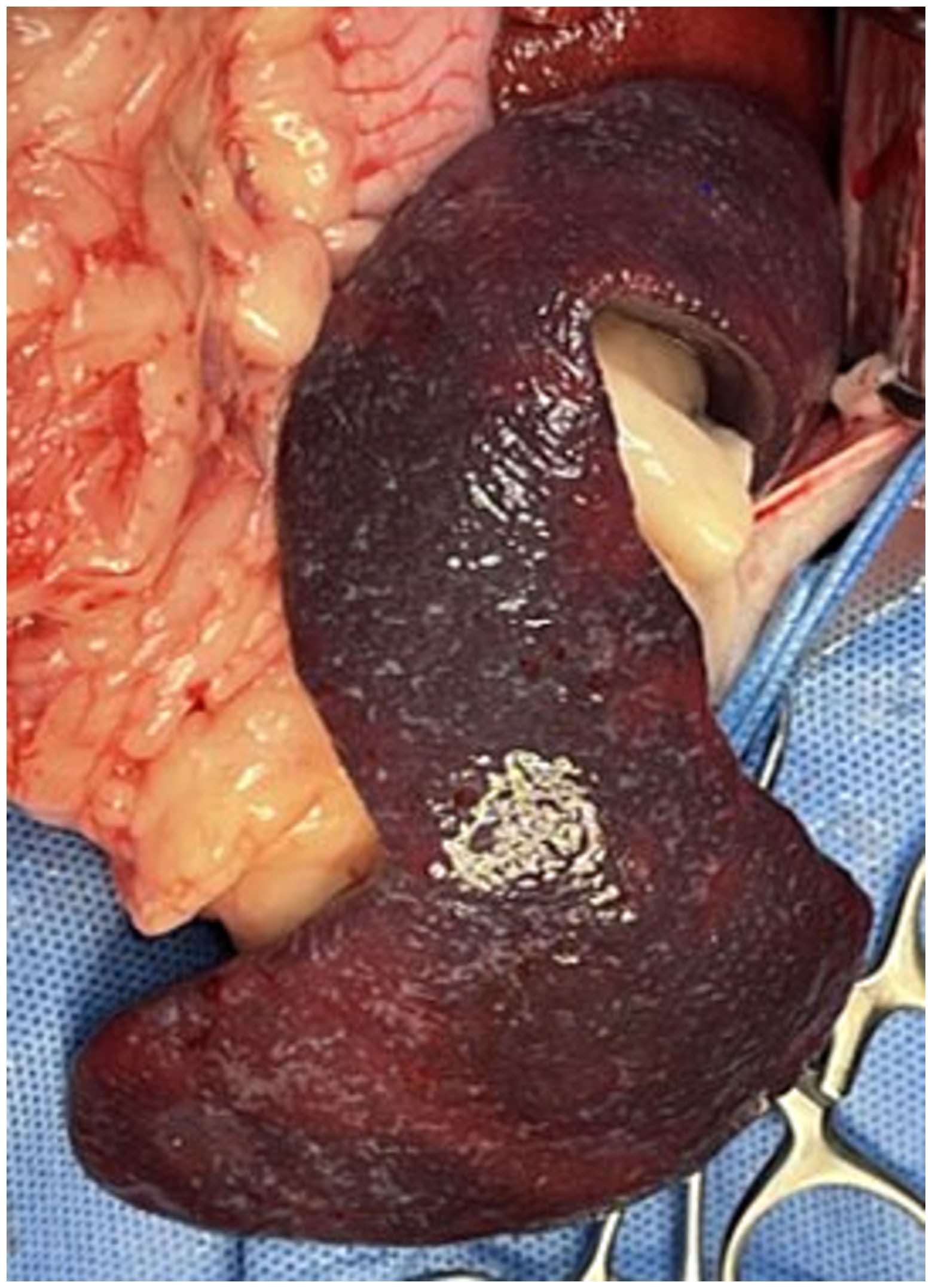
↑ 脾脏明显肿大,边界不规则,并呈现弥漫性暗红色变色,提示充血。
肝脏不规则,右外侧叶和内侧叶较小,其余叶肥大。从每个肝叶获得肝组织样本,并使用穿刺活检从左侧叶获得另外两个样本。使用止血海绵在穿刺活检部位实现止血。使用LigaSure血管密封装置切除了肿大充血的脾脏。用温热的无菌盐水大量灌洗腹腔并常规闭合。
肝脏组织学检查显示门静脉发育不全、多灶性异常微血管系统、中度至明显液泡变性、轻度至中度胞浆内肝细胞色素蓄积和多发性脂肪肉芽肿(下图)。这些发现在所有肝叶中都是一致的,提示门静脉原发性发育不全(PHPV)。
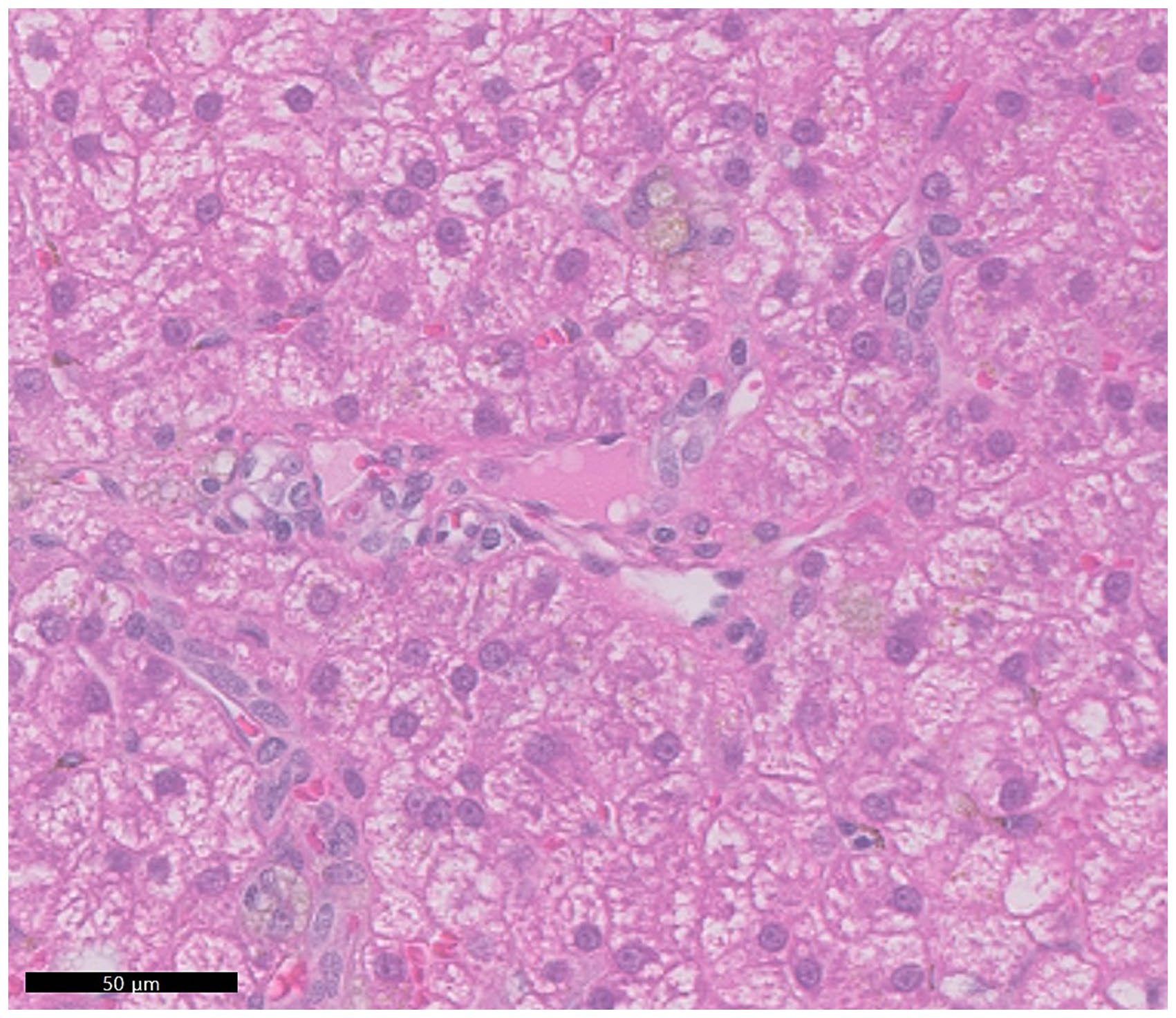
↑ 门静脉很小,几乎无法辨认。在肝细胞的细胞质内观察到弥漫性的中度液泡变性。肝细胞通常表现出淡棕色颗粒状色素的轻度积累,可能表明脂褐质或铁的沉积。
肝组织中的铜浓度正常(152 ppm,干重)。引起传染性肝炎的犬腺病毒1型和2型的PCR检测呈阴性,未检测到细菌或真菌。
脾脏组织学检查显示轻度至中度充血和复杂的结节性增生。根据组织学检查结果、诊断影像学和实验室检查,患者最终被诊断为PHPV。
04 预后
术后第1天,出现呕吐、厌食、嗜睡、腹胀、低血压(收缩压80 mmHg)。轻度贫血(血细胞比容31.3% [37.3–61.7])、白细胞增多(33.3 K/μL [5.05–16.76])、低白蛋白血症(1.9 g/dL [2.2–3.9])、C反应蛋白升高(>10 mg/dL [0.1–1])、肝酶升高,包括AST(131 U/L [0–50])和ALT(192 U/L [10–125])。犬胰腺特异性脂肪酶(830 ng/mL [200–400])和D-二聚体(2064 ng/mL [50–250])升高。
术后治疗包括前12小时连续输注芬太尼(4 μg/kg/h),然后进行液体治疗、新鲜冰冻血浆输注(10 mL/kg IV BID)5天、马罗吡坦(1 mg/kg IV 每天)、昂丹司琼(1 mg/kg IV BID)和连续输注甲氧氯普胺(1.5 mg/kg/天 IV)7天,连续输注法莫替丁(8 mg/kg/天 IV)3天。术后第1天引流腹水349 mL,第3天抽出腹水350 mL。均为渗出液。
术后第4天,呕吐消退,食欲恢复。腹部超声显示门静脉速度为18 cm/s,在参考范围内(下图A)。腹腔积液无进一步增加,于术后第7天出院。
术后第10天,腹部超声显示门静脉速度为17 cm/s,未检测到进一步的积液(下图B)。除活检区域外,肝脏病变未出现变化。
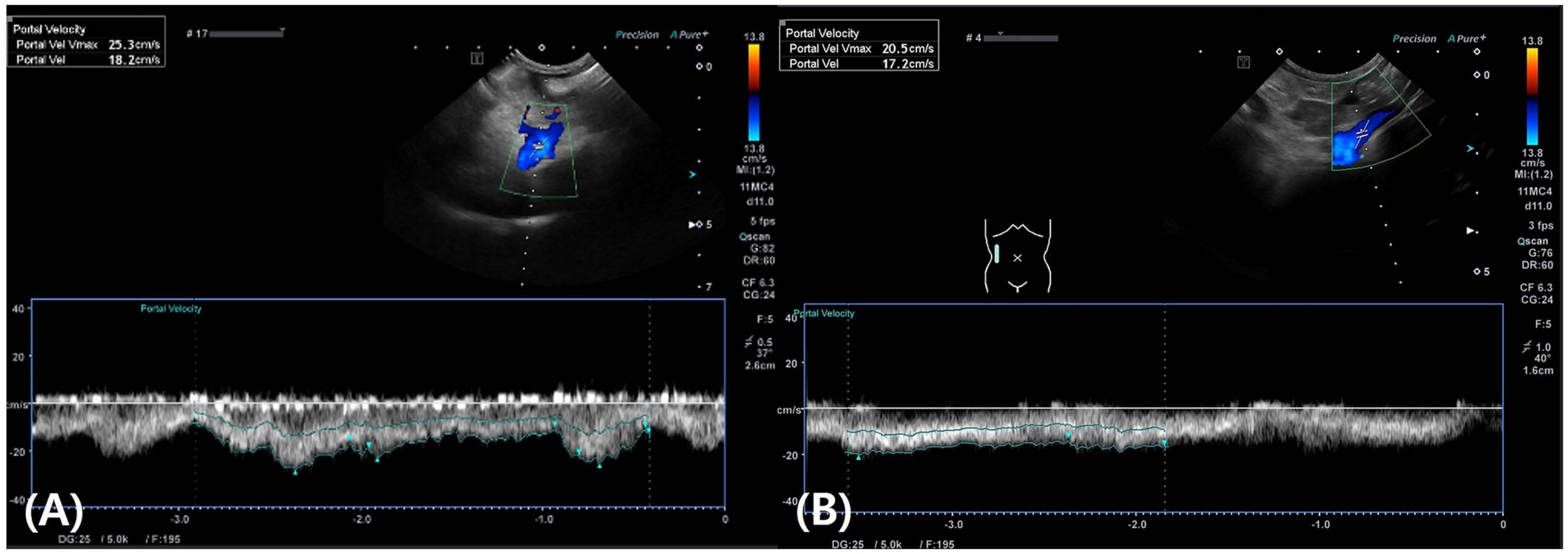
↑(A)术后第4天,门静脉速度恢复正常(18 cm/s)。(B)术后第10天,门静脉速度保持在17 cm/s的正常范围内。
术后第15天,活力良好,食欲正常,无腹胀,体重稳定在4.2公斤。全血细胞计数、血生化和凝血结果均在参考范围内。
术后4个月,主人报告说,患者不再因腹水而出现腹胀,体重也保持不变。
05 讨论
门静脉高压(Portal hypertension,PH)是门静脉系统内压力的病理性升高。在人类医学中,PH定义为肝静脉压力梯度大于6 mmHg。当该梯度超过12 mmHg时,可能会出现静脉曲张出血和腹水等并发症。
在兽医学中,很少直接或间接测量门静脉压。因此,PH通常根据临床证据(如腹水、多发性获得性门体分流和肝性脑病)或使用多普勒超声评估的门静脉血流动力学来诊断。
PH在解剖学上可分为肝前性、肝内性或肝后性,每种类型都是由门静脉系统不同部位的阻力升高引起的。肝前性PH是由于肝外门静脉阻塞或腔外压迫所致。肝内性PH是由于门静脉支流、肝窦动脉和小肝静脉内的阻力增加引起的。
肝后性PH归因于大肝静脉、肝后后腔静脉或右心房水平的闭塞。肝后性原因是狗和猫PH最常见原因,最常见的例子是右心衰竭、心包疾病和肺动脉高压。
门静脉原发性发育不全(PHPV)是一种先天性血管异常,是狗肝内性PH的罕见原因。在PHPV中,肝外门静脉可能异常小或缺失,这在某些情况下会影响肝内静脉。非肝硬化PH、微血管发育不良、特发性肝纤维化和肝门静脉纤维化是用于描述这种情况的术语。然而,世界小动物兽医协会关于犬和猫肝病的指南已提议标准化PHPV的术语。
PHPV的临床症状因门静脉发育不全的严重程度而异。在轻度病例中,可能不存在PH,而在严重的情况下,可能会观察到PH和肝性脑病的症状。
PHPV的治疗重点是缓解PH症状和预防危及生命的并发症。对于患有PHPV引起的PH的狗,药物治疗仍然是主要方法,包括支持性治疗,限制蛋白质和钠的饮食、利尿剂(如呋塞米和螺内酯)和抗溃疡剂。继发于PH的多发性获得性门体分流(MAPSS)的狗采用低蛋白饮食、抗生素和乳果糖进行管理。然而,迄今为止,还没有关于狗PHPV手术治疗的报告。
PHPV通常在2岁以下的狗中出现临床症状,据报道在约克夏犬和玩具贵宾犬等品种中更为常见。在轻度病例中,PH可能不存在,但肝酶可能会持续或间歇性轻微升高。在更严重的情况下,临床表现包括神经系统体征、多尿、烦渴、间歇性胃肠道症状、嗜睡和腹水。
在本病例中,狗在11岁高龄时出现了与PHPV引起的PH相关的腹水。尽管PHPV是一种先天性血管异常,但根据老年犬表现出的PHPV症状以及患有PHPV的狗血清总胆汁酸水平随时间升高的记录,推测它是一种进行性疾病。
目前,兽医学中尚无针对PHPV诱发的PH的特异性治疗方法。对于狗来说,主要方法包括通过限制钠和利尿剂来控制腹水。在人类中,特发性非肝硬化门静脉高压症的治疗与PHPV诱导的狗PH类似,主要侧重于控制静脉曲张出血。通过使用非选择性β受体阻滞剂或内窥镜静脉曲张结扎术来实现。
在难治性病例中,可以使用分流干预或肝移植。分流干预分为选择性或非选择性。选择性分流术,如远端脾肾分流术和小直径经颈静脉肝内门体分流术(TIPS),可转移部分门静脉血流,保留肝功能并降低肝性脑病的风险。非选择性分流术,包括门静脉分流术和大直径TIPS,可转移总门静脉血流,提供更好的静脉曲张出血控制,但脑病的风险更高。在狗中,除钠限制和利尿剂以外的治疗尚未被报道,大多数病例会使用安乐死。
本病例进行的脾切除术可导致门静脉速度正常化、腹水消退的原因主要为:
- 首先,脾切除术通过消除脾脏充血的血流来减少门静脉流入。
- 其次,脾切除术可能会降低肝静脉血中内皮素-1(ET-1)的水平并增加NO的水平。ET-1是一种血管收缩剂,调节肝星状细胞的收缩力并调节肝内门静脉血管阻力。去除脾源性ET-1可松弛星状细胞,从而降低肝内门静脉血管阻力。改善的肝窦循环会增加肝窦内皮细胞的剪切应力,从而恢复NO的产生。
- 第三,脾切除术可以降低外周血中的ET-1和NO水平。脾源性ET-1的消除可减少内皮素受体B介导的内皮NO产生。尽管肝静脉血中NO浓度的增加和外周血中NO浓度的降低可能看起来是矛盾的,但这些发现表明脾切除术有可能改善肝内门静脉血管阻力以及内脏和全身超动力循环。
因此,尽管没有解决潜在的肝血管异常,例如门静脉发育不全或异常的微血管系统,脾切除术仍可促进门静脉速度的正常化。
本病例报告描述了PHPV诱导的狗PH的诊断和成功治疗,强调了脾切除术在解决腹水和改善门静脉血流动力学方面的功效。脾切除术可能是治疗对药物治疗无反应的PHPV诱发的PH狗腹水的潜在治疗选择。
文献来源:Shin JH, Han HJ. Case Report: Successful surgical intervention for portal hypertension caused by primary hypoplasia of the portal vein in a dog. Front Vet Sci. 2025 May 27;12:1582290.