
| 一般情况 | |
 | 品种:混种犬 |
| 年龄:10岁 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:神经淋巴瘤 | |
01 主诉及病史
因左后肢跛行持续4周就诊。
当地拍摄的四肢X光片未见异常。镇痛治疗未能缓解临床症状。
02 检查
左前肢与后肢均存在重度跛行,且全身骨骼肌严重萎缩。因既往确诊过利什曼原虫感染,故进行血清学(伯氏疏螺旋体、犬埃立克体、嗜吞噬细胞无形体、犬巴贝斯虫、利什曼原虫)及分子学血液检测。除嗜吞噬细胞无形体滴度呈阳性(28.7 [<8])外,PCR及血清学检测均未发现异常。
血常规、生化指标(含C反应蛋白)及尿液分析均正常。因此可排除利什曼病复发或其他媒介传播疾病作为跛行潜在病因的可能性。
10天后神经系统检查显示:四肢瘫痪无法行走,左侧更明显;四肢本体感觉轻度减退;双后肢节段反射显著减弱;左前肢节段反射轻度减弱,右前肢节段反射正常;皮下脂肪层反射减弱但可诱发;胸腰椎触诊疼痛。除右侧瞳孔散大且瞳孔对光反射消失(疑为眼肌麻痹)外,颅神经检查未见异常。据此初步诊断为全身性多发性神经病,但不能排除多灶性中枢神经系统疾病的可能性。
头部及颈椎MRI仅显示脑沟轻度加深,可能与年龄相关。其余检查结构未见形态学异常。
胸部CT显示胸腔结构无异常。腹部CT提示脾脏轻度肿大(边缘圆润),实质密度正常。肾上腺轻度增大(左8.2毫米,右7.4毫米)。肠系膜淋巴结短轴直径5.5毫米,轻度肿大,造影后增强不均。其他腹部器官均无异常。
可见左后肢及臀部肌肉明显萎缩,腰骶部椎管内及增大的左侧L7神经根处出现轻度造影剂强化(下图)。据此推测左侧L7/S1椎间隙存在脊神经炎症,导致神经源性肌肉萎缩。
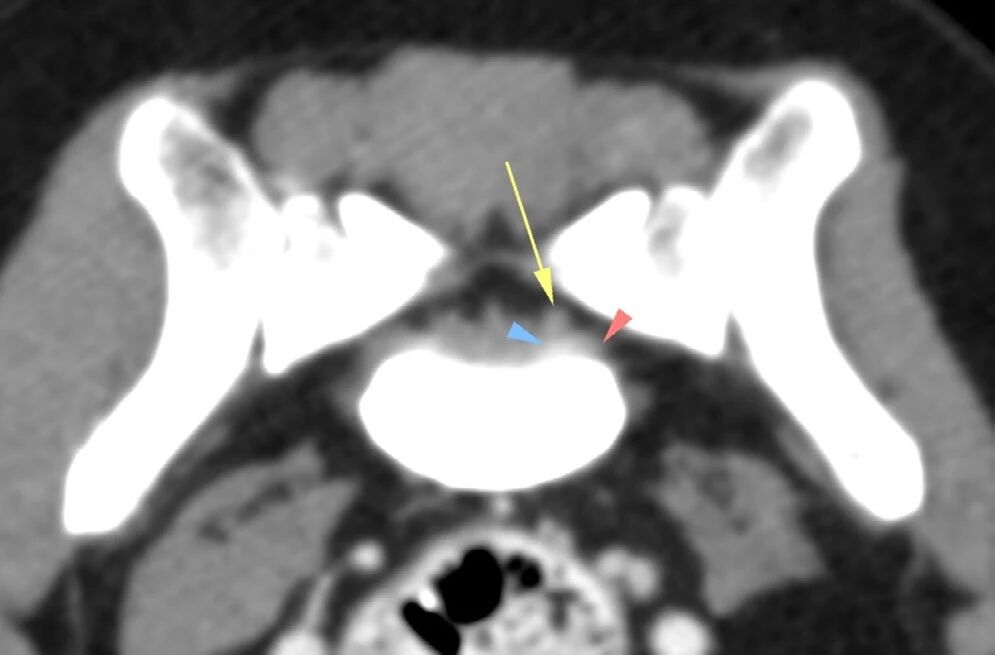
↑ L7-S1脊柱的CT图像(横截面,软组织重建,经过对比后),显示了增大的神经(箭头)和周围组织的轻度对比增强(三角)。
通过腰穿获得的脑脊液分析显示,淋巴细胞明显增多(837个/μL,蛋白14843.8mg/L),以中等和大型淋巴细胞为主,小型成熟淋巴细胞数量少(<20%),有罕见的有丝分裂象(下图)。这些发现提示为中等到大细胞淋巴瘤。
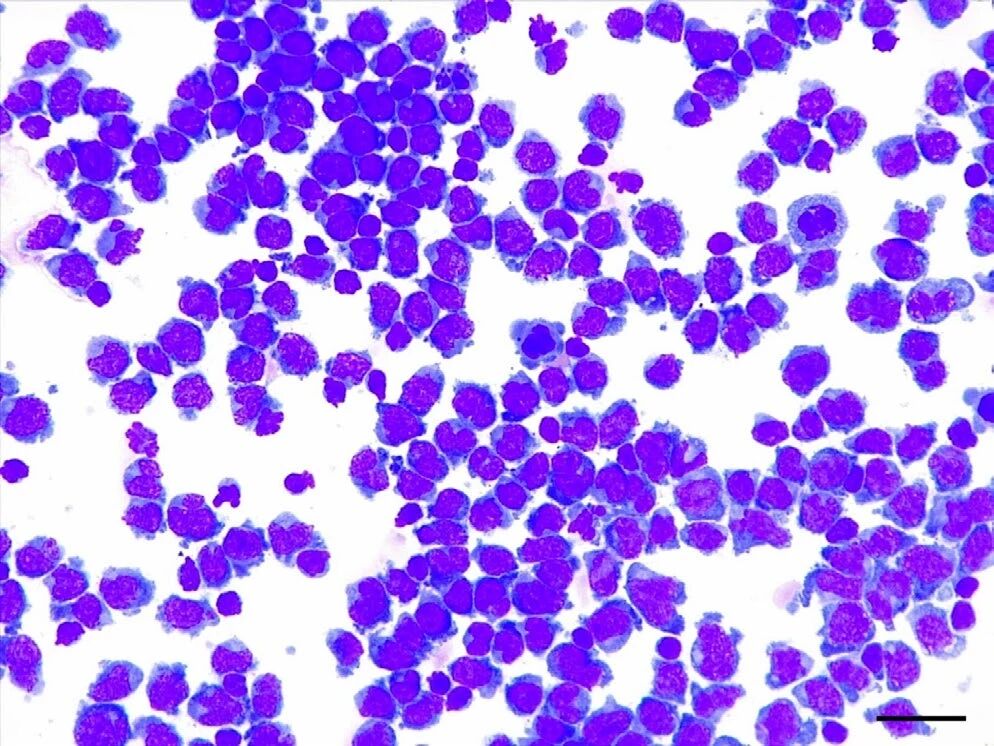
↑ 脑脊液的细胞学分析显示高度细胞增生,以中型和大型淋巴细胞为主,且小型成熟淋巴细胞数量较少。
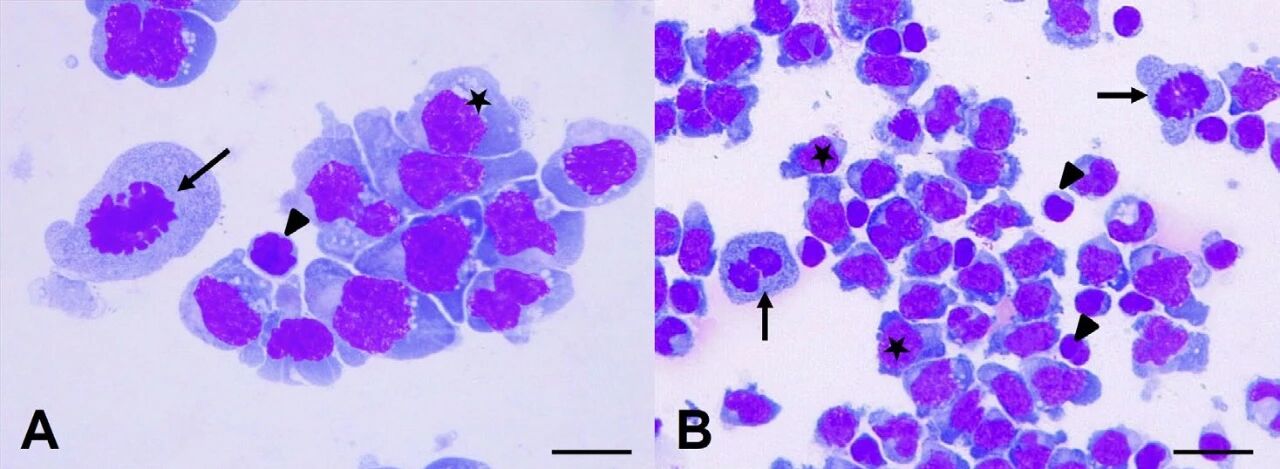
↑ 脑脊液显示出大圆细胞(星号),伴有少量中等嗜碱性、部分空泡化的细胞质。也可以看到有丝分裂像(箭头),以及小淋巴细胞(三角)。
免疫组化显示超过95%的细胞对CD3具有中等的膜和细胞质染色,而对PAX5的中等阳性细胞则不足3%,且呈核染色模式。因此,被认为最可能是T细胞来源,诊断为T细胞淋巴瘤。
03 治疗
开始采用泼尼松龙、长春新碱、阿糖胞苷和洛莫司汀进行化疗。先使用阿糖胞苷(150 mg/平方米,q12h皮下注射一次,持续48小时),同时口服泼尼松龙(40 mg/平方米,q24h)。
7天后,静脉推注长春新碱(0.7 mg/平方米),并减少泼尼松龙剂量至30 mg/平方米,q24h。
7天后,接受洛莫司汀(60 mg/平方米),并降低泼尼松龙剂量(20 mg/平方米,q24h)。每次应用细胞抑制剂时,同时给予马罗吡坦(1 mg/kg,皮下或静脉给药)。额外处方2-3天马罗吡坦(2 mg/kg,q24h)。
04 预后
化疗第1周及第2周出现腹泻。给予车前子(0.5 g/kg/日)及益生菌(1.5 g/日)直至症状消退。未记录中性粒细胞减少或血小板减少事件。
化疗3周后(洛莫司汀给药1周后),病情恶化,出现左侧面瘫及霍纳综合征。左前肢及双后肢的节段反射完全消失。因疾病进展,该犬被实施安乐死。
05 尸检
尸检脑部MRI未显示其他异常。脊髓显示T11-L2腹侧硬膜外间隙缩小,该区域中央管轻度扩大(下图)。
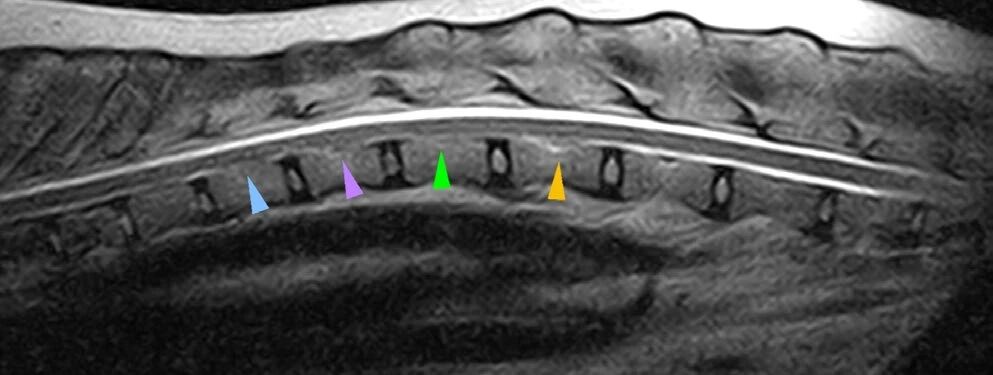
↑ 矢状面T2加权MRI显示脊髓(胸腰段)在Th11-L2区域的腹侧硬膜外空间减小(三角)以及该区域中央管轻度扩张。
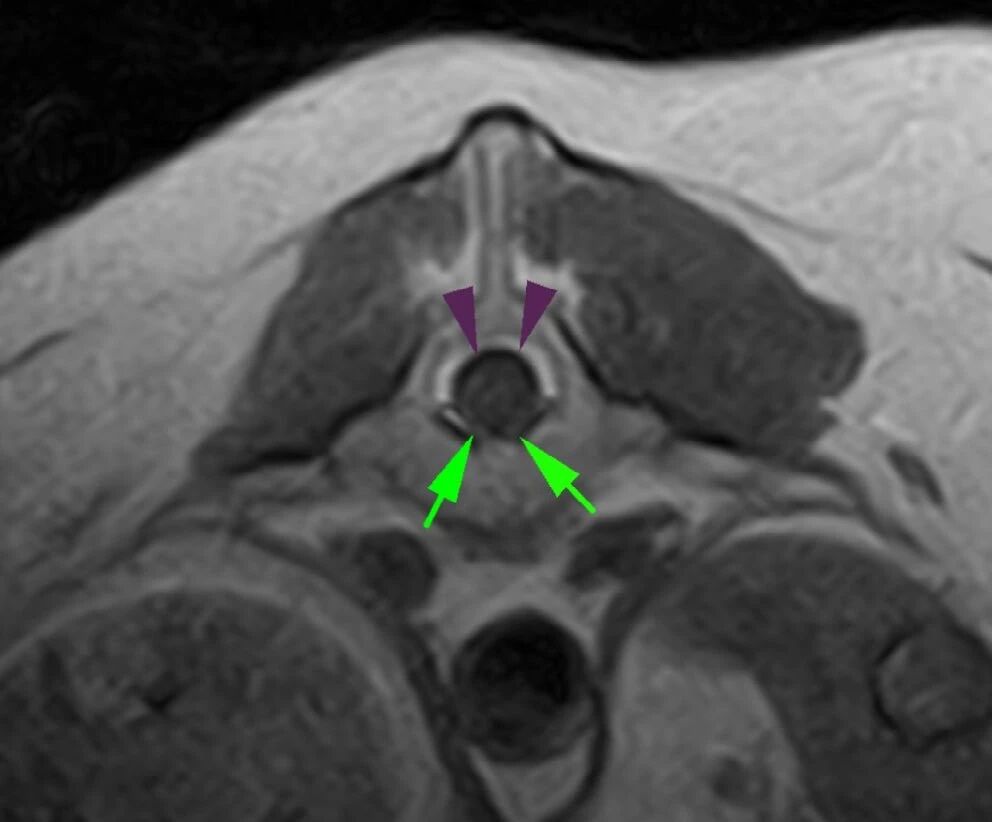
↑ 横断面T1加权MRI显示第一腰椎的腹侧硬膜外空间减小(箭头),与该空间的背侧部分(三角)相比。
脑脊液细胞学检查显示轻度淋巴细胞性细胞增多(22×10³/μL,蛋白质1840.3 mg/L),以大型圆形细胞为主,胞浆呈中等蓝色,核呈中至大型椭圆形,染色质呈颗粒状(下图)。
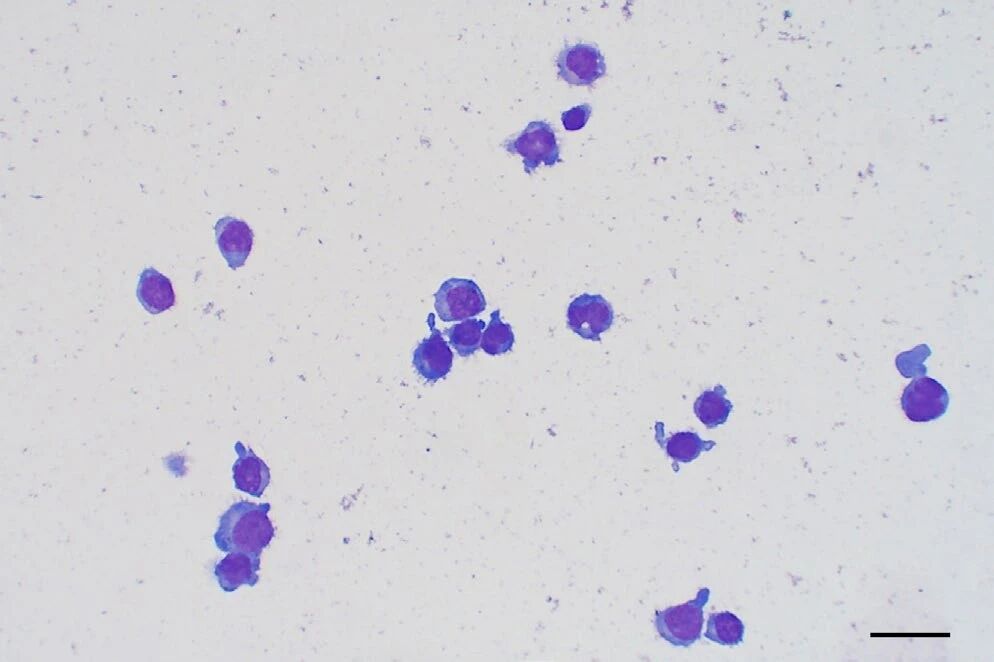
↑ 脑脊液显示低至中等的细胞增多,主要为大而圆的细胞,具有适量的蓝色细胞质和中等至大型、不规则的圆形细胞核,核内有细颗粒的染色质。
尸检显示脊神经根及神经节弥漫性增厚,并在右侧L6脊神经腹侧根处发现一处硬膜下米色肿块(0.4×0.3×0.2厘米)(下图)。组织学显示,颈髓第二、三节段(C2、C3)存在大淋巴细胞中度硬膜下浸润。在颈段C6、C7及腰段L2、L3、L6区域可见严重至完全性硬膜下、神经内及神经节内弥漫性至多灶性淋巴母细胞结节浸润。坐骨神经代表性切片显示轴突肿胀及髓鞘的沃勒氏变性。右侧臂丛神经可见类似病变,而左侧臂丛神经则呈现淋巴母细胞弥漫性神经内浸润。上述发现符合周围神经系统淋巴瘤特征,据此确诊为神经淋巴瘤。
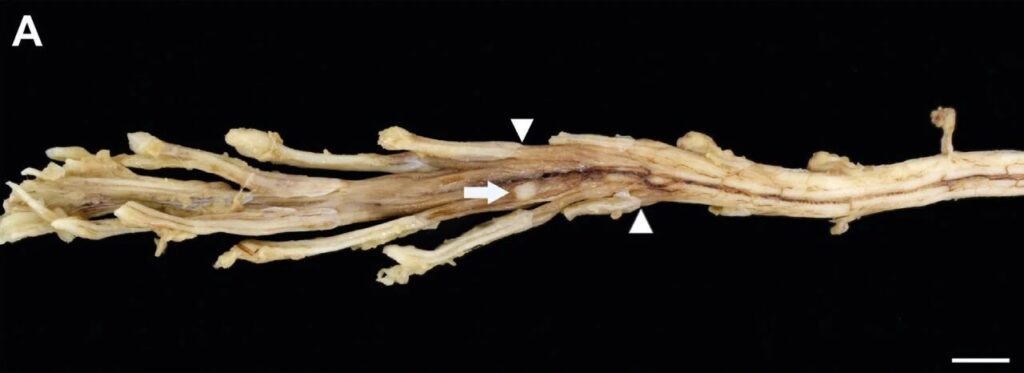
↑(A)腰脊髓表现为脊神经根和神经节的弥漫性增厚。一个位于右侧L6脊神经腹根旁的丘状米色肿块(0.4 × 0.3 × 0.2 cm)(白箭头)。箭头指示从中枢到外周神经组织的过渡,组织突然增厚并呈米色变色,与组织病理学上可检测到的肿瘤细胞浸润相对应。
大脑仅见少量局灶性淋巴细胞性血管周围套环及轻度含铁血黄素沉着。此外可见多灶性血管周围水肿、寡灶性胶质细胞结节,以及多灶性神经元吞噬现象和卫星细胞增生。大脑及小脑的软脑膜、颅神经或脑实质中未见大淋巴细胞浸润。免疫组化检测可见浸润性大淋巴细胞表达CD3,未见PAX5免疫标记,由此确认为T细胞来源(下图)。
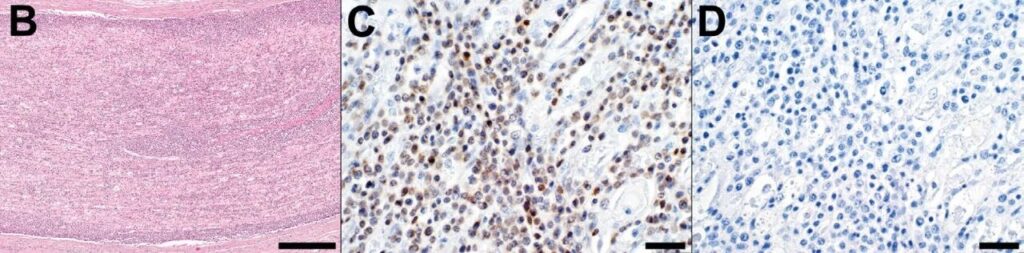
↑(B)病理学显示中间至大型圆形细胞(淋巴母细胞)组成的片状浸润并扩展至C6脊神经。(C)CD3(T细胞)阳性免疫组化染色。(D)PAX5(B细胞)阴性免疫组化染色。
06 讨论
神经淋巴瘤(Neurolymphomatosis)是一种罕见的肿瘤性疾病,主要表现为外周神经、神经根、颅神经和神经丛被神经亲和性肿瘤细胞浸润。在人类医学中,该病通常与非霍奇金淋巴瘤或白血病的结外变异型相关。
在兽医学中,淋巴瘤和白血病也是常见的疾病,尤其是淋巴瘤,是猫和狗中最常被诊断的肿瘤之一。尽管大脑和中枢神经系统偶尔也会受到这种疾病的影响,但外周神经的受累却很少被报道。
本病例描述的是一例罕见的原发性T细胞神经淋巴瘤,主要影响神经根、神经丛和脊神经。诊断影像学检查未发现异常,但脑脊液的细胞学分析显示高度的淋巴细胞性多形性,主要是中等大小和大的淋巴细胞,以及罕见的有丝分裂象,这强调了在周围神经疾病中进行脑脊液检查的重要性。
在本病例中,肿瘤似乎主要起源于脊神经和背神经根神经节的硬膜下腔,因为没有发现其他器官的多中心性表现。肿瘤细胞似乎没有显示出对中枢神经系统(脊髓和大脑)的亲和性,大脑中的病变可能是反应性的。然而,肿瘤细胞似乎沿着周围神经扩散,如左侧臂丛神经所示。
此外,其他周围神经虽然在检查的节段中没有浸润,但显示出与更近端神经损伤一致的病变。可以推测,相应神经根也会发现类似的组织学变化。左侧臂丛神经内的弥漫性神经内浸润解释了狗在疾病进展过程中出现的霍纳综合征。尽管这只是推测,但可以假设肿瘤细胞也侵入了左侧面部神经,从而导致了疾病过程中出现的面部瘫痪。
尽管在人类医学中,神经淋巴瘤主要与非霍奇金淋巴瘤或白血病相关,但本病例中的狗在临床检查、全血细胞计数和临床生化检查中均未发现异常。CT扫描中脾脏和腹部淋巴结的变化是非特异性的,被认为与临床症状无关。这也在这些结构的组织病理学检查中得到了支持,其中没有检测到肿瘤细胞。因此,可以认为这里呈现的周围神经系统淋巴瘤是原发性的。
该狗接受了泼尼松龙、长春新碱、阿糖胞苷和洛莫司汀的化疗,这是根据文献中成功应用于T细胞淋巴瘤伴脊髓受累的单个病例的化疗方案。化疗总体上是耐受良好的,狗没有因不良事件而住院。该方案中包含的化疗药物是基于它们能够穿过狗的血脑屏障。
在狗中,中枢神经系统淋巴瘤作为多中心疾病的一部分,患病率为12%-30%。然而,外周神经系统较少受到影响。作为原发性疾病的神经淋巴瘤在狗中是不常见的,只有少数病例报告。在比较这些病例时,坐骨神经及其分支似乎是外周神经系统中最常受影响的部分,其次是脊神经根、脊神经和脊神经节。这与本病例一致。
总之,神经淋巴瘤是一种罕见的肿瘤性疾病,在狗和其他动物中应被视为多发性神经病的鉴别诊断之一,即使影像学结果大多正常。脑脊液细胞学是一种有用的生前诊断测试,可以由受过训练的兽医轻松进行,无需昂贵的设备。
文献来源:Müller MK, Irmscher M, Goldbach N, Haake AFH, Kershaw O, Baloi PA. Neurolymphomatosis of T-Cell Origin in a Dog. J Vet Intern Med. 2025 Jul-Aug;39(4):e70189.