
| 一般情况 | |
 | 品种:西高地白梗 |
| 年龄:7岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:多发性骨髓瘤 | |
01 主诉及病史
怀疑多发性骨髓瘤被转诊。
因双侧后肢共济失调就诊于当地动物医院。最初症状类似于跛行,怀疑是关节疾病。给予非甾体抗炎药治疗3周,但症状逐渐加重。随后进行了CT和MRI。影像学检查发现第三腰椎椎体处有一肿块,压迫L3-L4水平脊髓。在多个椎体(包括髂骨、耻骨和肋骨)中也检测到肿块。还观察到纵隔和腹部淋巴结肿大,肝脏肿大且存在低密度肝病变,肝脏、脾脏、右肾上腺和肾脏实质变化,这些表现引发了对多发性骨髓瘤的怀疑(下图)。随后该犬被转诊接受化疗。
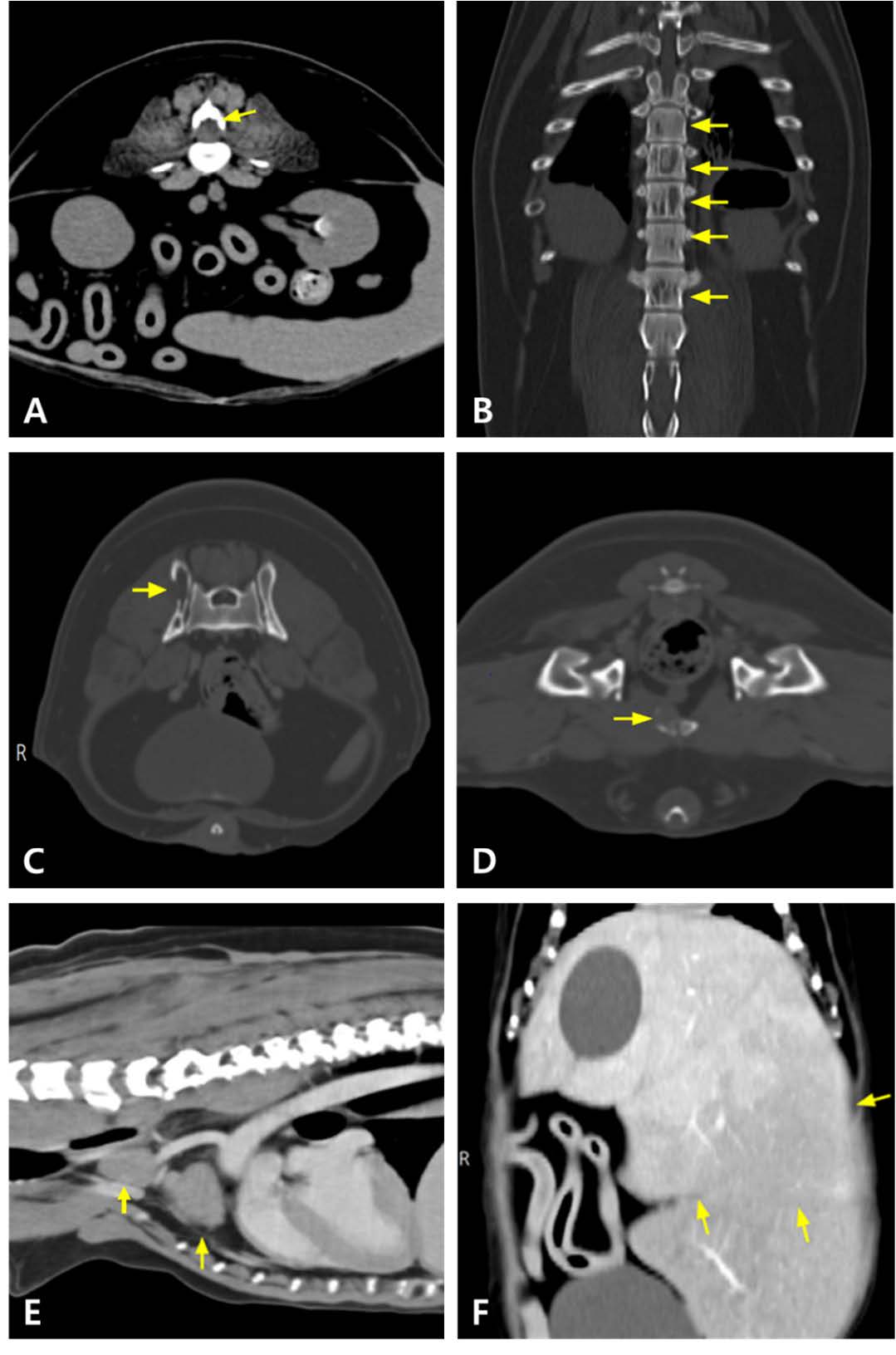
↑ CT结果。在横断面(未增强)图像上,L3水平肿块(箭头)和椎体骨溶解(A)。在胸椎和腰椎的多个区域观察到低密度区域(未增强)(箭头)(B)。在髂骨(箭头)(C)和耻骨(箭头)(D)区域发现骨溶解病变(增强后)。纵隔淋巴结(箭头)(E)和肝脏(箭头)(F)显著肿大(增强后)。
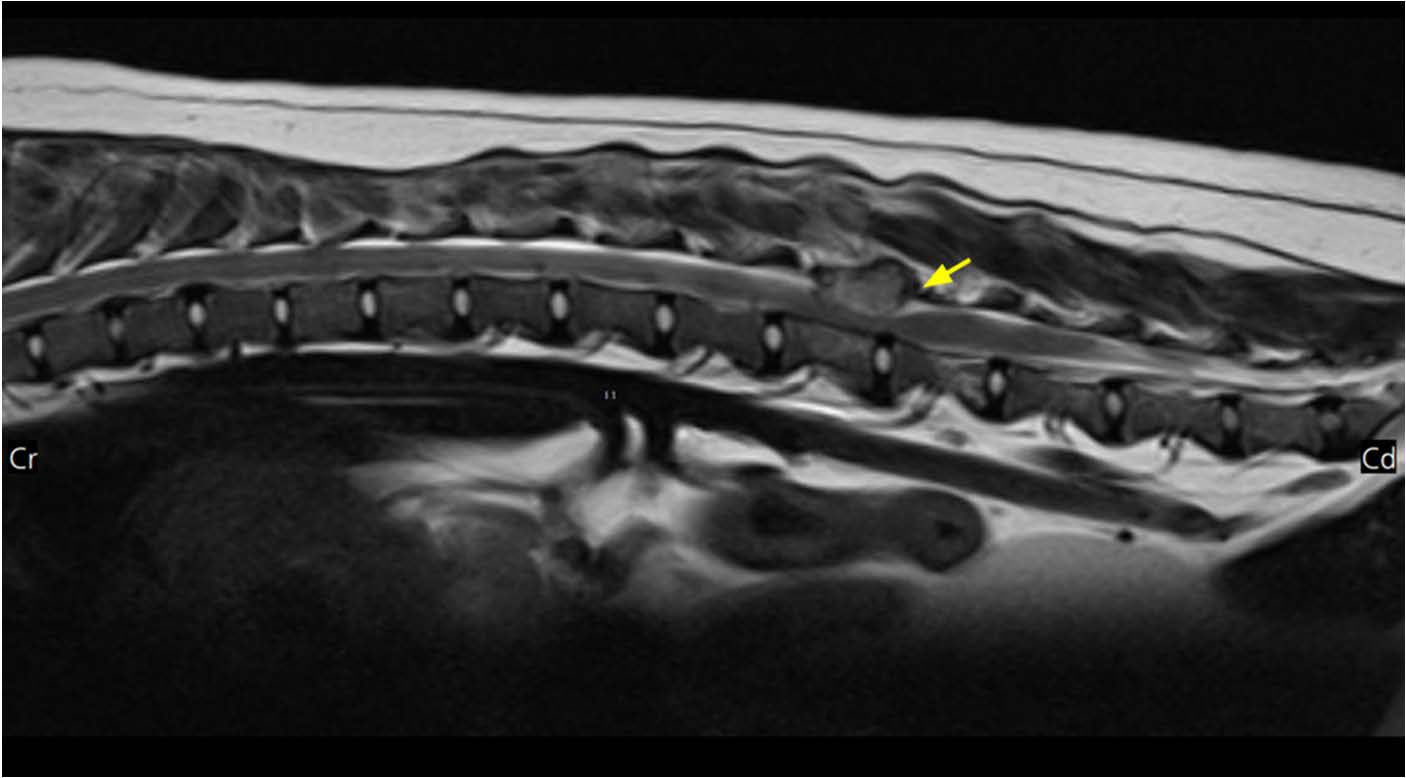
↑ MRI结果。在T2加权、未增强的矢状面图像上,L3-L4水平的肿块(箭头)正在压迫脊髓。
02 检查
体重8.95公斤。收缩压160 mmHg,提示轻度高血压。血液学检查显示轻度贫血(红细胞比容30.8%),血液外观呈暗红色且黏稠,同时伴有显著的高蛋白血症(总蛋白19.6 g/dL)、高球蛋白血症(17.4 g/dL)和轻度高钙血症(12.9 mg/dL)。血涂片显示红细胞聚集和成团,以及在深蓝色背景下的大量影细胞。
为进一步评估多发性骨髓瘤,进行了血清蛋白电泳,结果显示在β2区存在单克隆丙种球蛋白增多,尿液分析显示Bence-Jones蛋白尿呈阳性。
对脾脏、肝脏和外周淋巴结进行了细针穿刺抽吸。脾脏和肝脏的细胞学分析显示存在大量浆细胞,其特征为圆形细胞核、嗜碱性细胞质和明显的核周透明区(下图)。外周淋巴结中未观察到显著的肿瘤细胞。
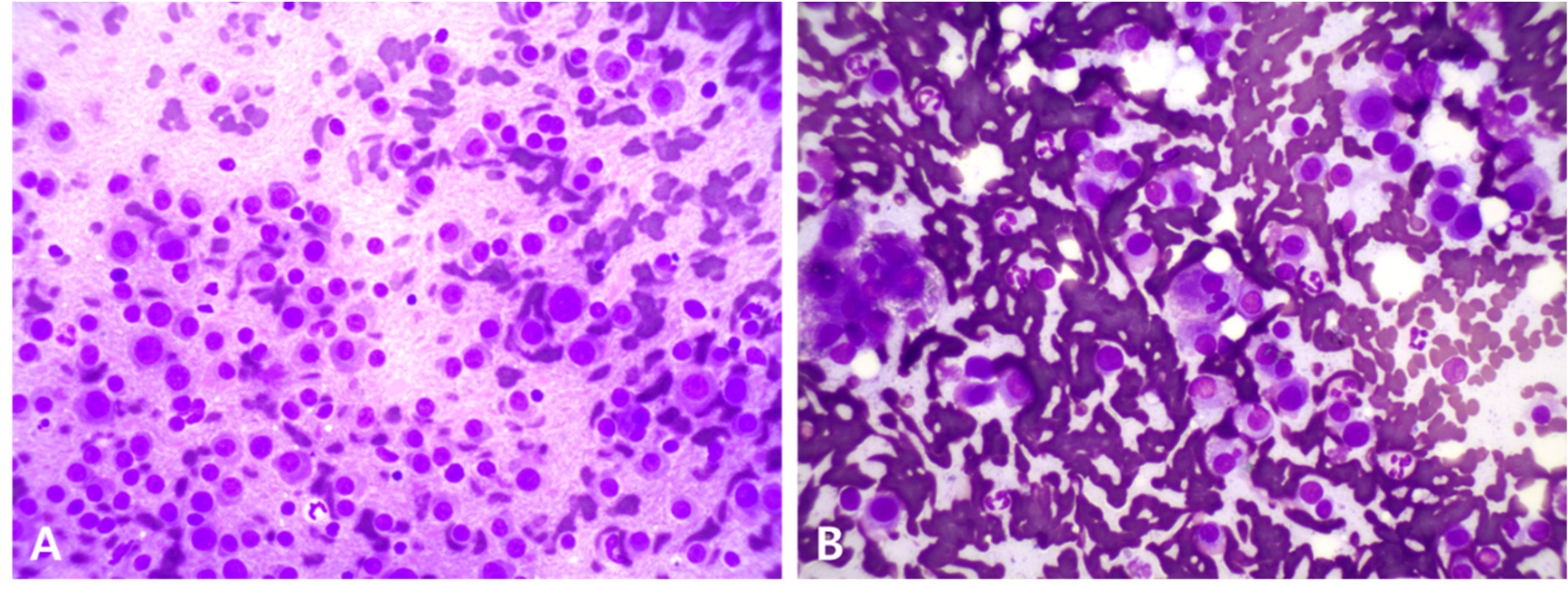
↑ 脾脏(A)和肝脏(B)的细胞学检查。主要观察到圆形细胞,具有蓝色细胞质、圆形细胞核和核周透明区。
根据影像学和细胞学检查结果,初步诊断为多发性骨髓瘤,累及椎体、髂骨、耻骨、肋骨及腹部器官(肝脏、脾脏和胸腹腔淋巴结)。由于患者临床状况较差,未进行组织病理学检查和骨髓活检。
03 治疗
鉴于患者严重的全身状况受损和可能由高黏滞度引起的循环障碍,开始进行支持性住院治疗,包括静脉输液和镇痛药。美法仑(0.1 mg/kg,口服,q24h)和泼尼松龙(0.5 mg/kg,PO,q24h)被作为多发性骨髓瘤的一线治疗药物。
9天后,总蛋白和球蛋白浓度分别降至16.3 g/dL和13.9 g/dL。然而,患者总体状况仍然较差,持续存在由于血液高黏滞度引起的循环问题、明显的腹痛,以及显著升高的犬胰脂肪酶(1828.3 µg/L),符合胰腺炎。因此停用美法仑和泼尼松龙,并开始使用长春碱-阿霉素-地塞米松(VAD)化疗方案,以快速降低血液中蛋白质的浓度:长春碱(0.7 mg/m²,IV,第8天和第15天),阿霉素(30 mg/m²,IV,每21天一次),以及地塞米松(1 mg/kg,静脉注射,第1天、第8天和第15天)。
第20天,血清总蛋白和球蛋白水平进一步降至13.6 g/dL和9.2 g/dL。
第24天,患者出现了急性后肢本体感觉丧失、会阴反射消失以及自主排尿功能障碍。计划进行姑息性放疗,以缓解L3-L4椎体肿块对脊髓的压迫。
采用6兆伏特直线加速器进行容积调强放疗。大体肿瘤体积包括L3-L4处的增强病变以及从T11到L6的溶骨性改变。临床靶区体积被定义为围绕GTV的3毫米各向边界。总剂量为20 Gy,分五次照射(每天4 Gy,持续1周)。放疗与VAD方案同时进行,持续了大约2个月。
04 预后
完成放疗后的第二天,患者的后肢瘫痪和尿功能障碍得到缓解。
第53天,血清球蛋白水平升高,给予环磷酰胺(1 mg/kg,口服,q24h)治疗7天。
第81天,总蛋白和球蛋白分别降至6.5 g/dL和3.5 g/dL。红细胞比容和血小板计数分别降至19%和54 K/μL,提示骨髓抑制。患者还出现呕吐、厌食和倦怠。CT显示椎体肿块显著缩小,脊髓压迫得到缓解。肿块呈脂肪密度(88 HU)和轻度对比增强(46 HU)(下图)。纵隔淋巴结也有所缩小。然而,椎体、髂骨和耻骨的溶骨性病变仍然存在,腹部淋巴结和肾上腺肿大,以及肾梗死的进展也被观察到。
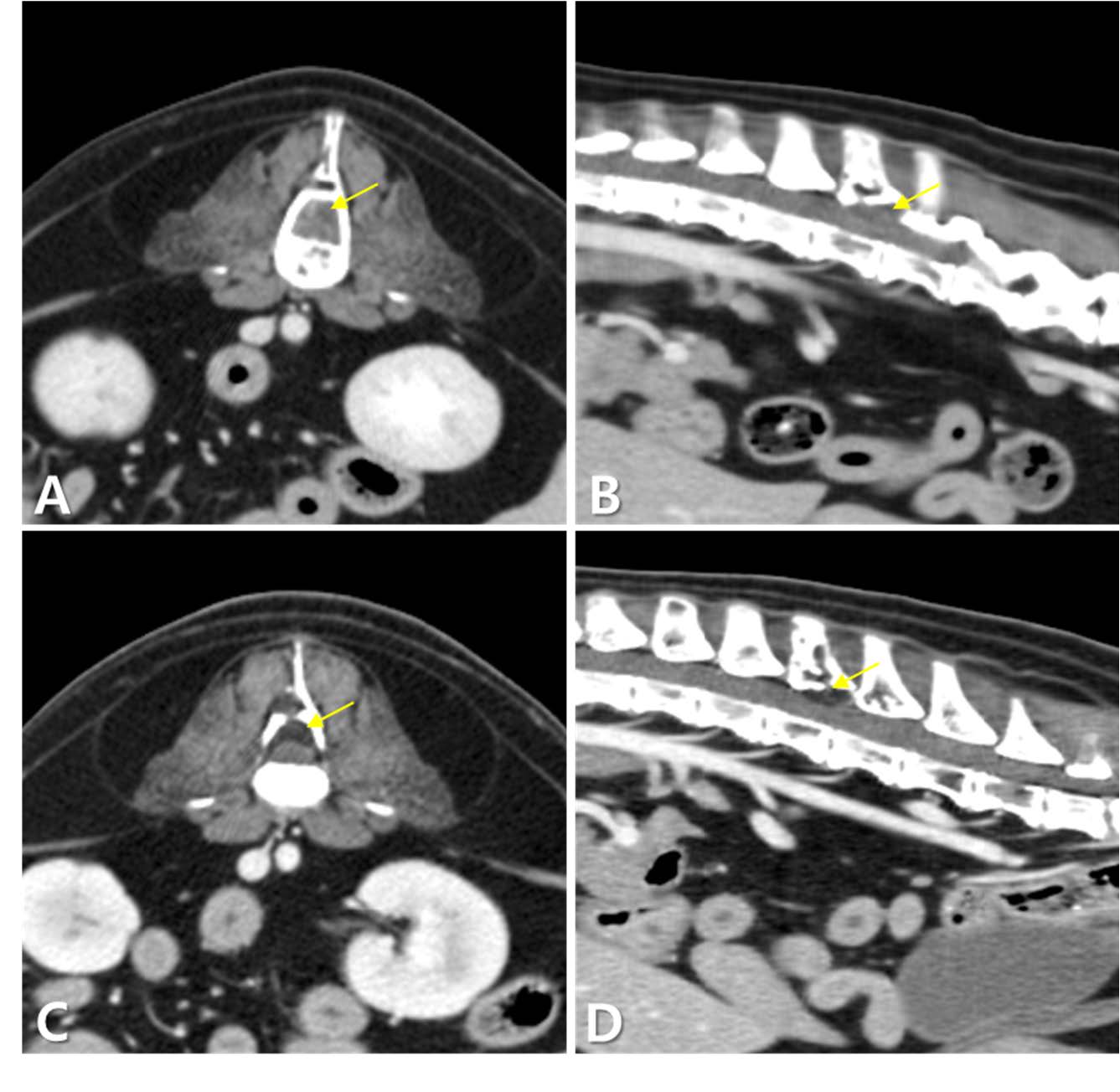
↑ L3-L4椎体水平肿块的增强CT图像,放疗前(AB)和放疗后(CD)。(AB) 放疗前的图像显示软组织密度肿块(箭头),压迫脊髓背侧。(CD) 放疗后的图像显示肿块(箭头)已转变为脂肪密度,体积显著减小,压迫得到缓解。
尽管存在VAD相关的副作用,患者临床状况仍然稳定,从而转为使用verdinexor单抗(1.25 mg/kg,口服,每周两次,后增加至1.5 mg/kg),并将其作为维持治疗。在随后的几周内,肿块大小和血清蛋白水平保持稳定,且身体状况和体重得以维持。
第190天,经过大约3个月的verdinexor单抗治疗后,患者出现血清蛋白水平升高、严重的胃肠道症状和倦怠。腹部超声发现一个巨大的腹腔内肿块(54.2×49.1 mm),推测为肝淋巴结肿大,十二指肠乳头处的肿块(8.1×20.2 mm)及胰腺体部的低回声肿块(11.8×8.7 mm)提示转移(下图)。
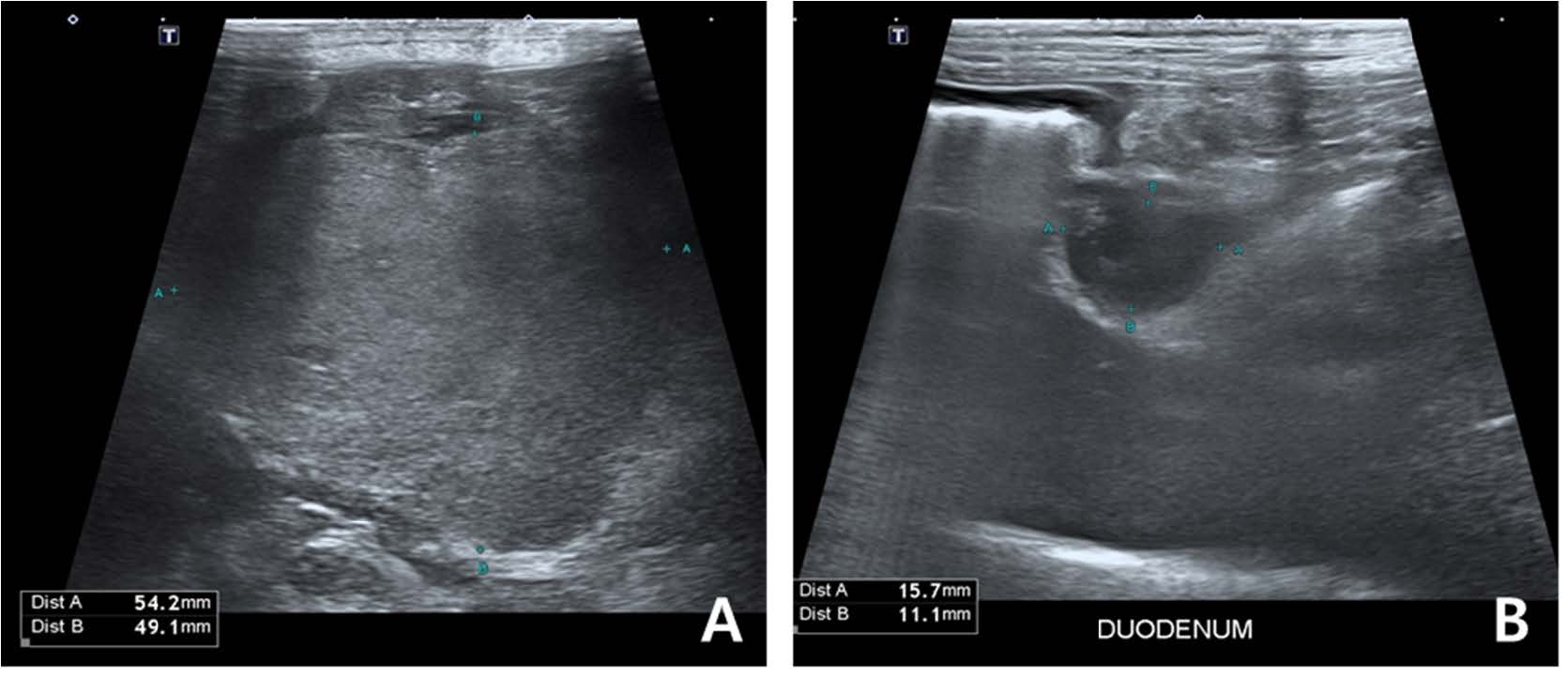
↑ 第189天腹部超声。在腹腔内观察到一个直径约为5厘米的肿块,怀疑是肿大的肝淋巴结(A)。在十二指肠水平还发现了一个额外的肿块(B)。
随后开始使用verdinexor单抗(1.67 mg/kg,口服,每周两次)、阿霉素(30 mg/m²,IV)和地塞米松(1 mg/kg,IV)的联合疗法,随后给予美法仑(7 mg/m²,口服,q24h,持续5天)。尽管治疗后球蛋白水平有所下降,但严重的骨髓抑制以及持续的临床恶化迫使停用所有药物。
在高球蛋白血症复发后,verdinexor单抗和洛莫司汀(70 mg/m²口服一次)联合使用,但未能产生有意义的临床或实验室改善。
第224天,停用了verdinexor单抗,并给予硼替佐米(1.3 mg/m²,IV,每周两次)和地塞米松(1 mg/kg,IV,每周一次)。硼替佐米在3周内逐渐增加剂量至1.65 mg/m²。
第238天,经过14天的治疗后,患者显示出临床改善,总蛋白和球蛋白水平下降。腹部超声显示之前检测到的肿块(包括肝脏和胰腺病变)显著缩小。
硼替佐米和地塞米松治疗了68天。除了轻度血小板减少症和胃肠道症状外,未观察到严重的不良反应。确定硼替佐米的最小有效剂量为1.45–1.65 mg/m² ,IV,每周两次,与美法仑或verdinexor单抗和地塞米松联合使用。
由于倦怠、恶心、发热、腹泻和细胞减少加重,后续停用了verdinexor单抗。尽管继续单独使用硼替佐米,但高蛋白血症和高球蛋白血症仍在进展。加入了托西尼布(3 mg/kg,口服,每周三次),但未观察到临床改善。
第296天,硼替佐米被卡非佐米(70 mg/m²,IV,每周一次)替代,后者维持了临床稳定,但未能改善实验室指标。
第315天,出现呕吐、腹泻、厌食、贫血、高蛋白血症、高球蛋白血症和高钙血症。超声显示肝淋巴结肿大加重,因此重新开始使用硼替佐米(1.65 mg/m²,IV,每周两次)。由于缺乏临床反应,随后给予伊沙佐米(1 mg/只,口服,每周一次)与地塞米松联合使用。然而3周后,高球蛋白血症持续存在且贫血加重,因此停用。尝试了紧急放血和红细胞输注,但均无效。
第339天,开始使用索拉非尼(3 mg/kg,口服,q24h)。即使与硼替佐米联合使用,在20天后仍未观察到显著改善。索拉非尼和硼替佐米的联合治疗持续了33天。尽管观察到球蛋白短暂下降,但随后出现反弹性高球蛋白血症、贫血、血小板减少症以及皮肤症状(脱毛、色素沉着和多处皮疹)(下图)。尿液分析显示与并发尿路感染相关的血尿,还观察到因结肠炎导致的便血。
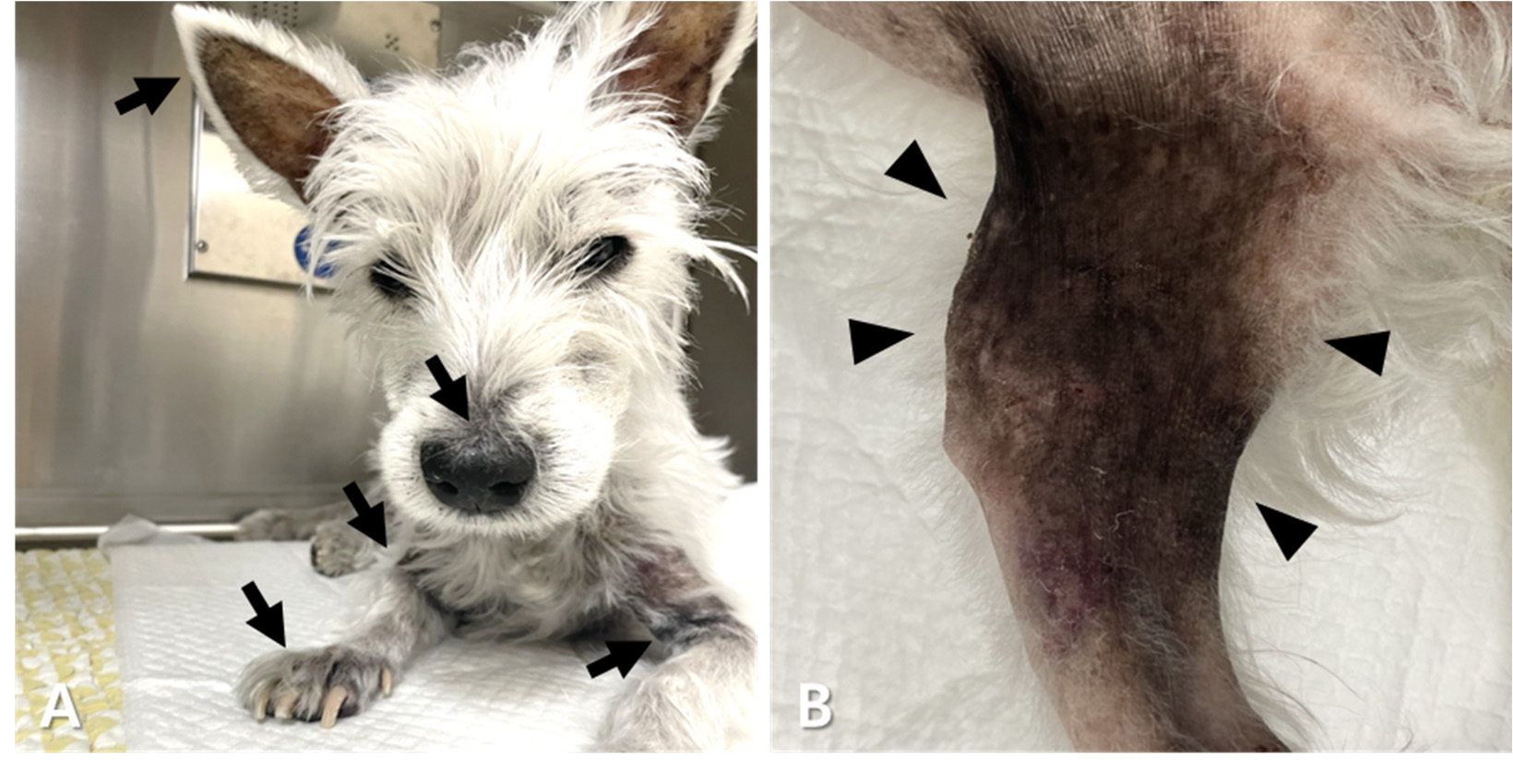
↑ 在耳廓、口吻部、颈部、腋窝区域和前肢观察到脱毛、皮疹和色素沉着(A;箭头),在腹股沟区域和后肢也观察到这些症状(B;箭头)。
第394天,进行了MRI,以调查新出现的尿潴留。未发现中枢神经系统病变。L3椎体病变在T1加权和T2加权图像上均显示出脂肪信号,并且体积缩小,对脊髓的压迫极小(下图)。
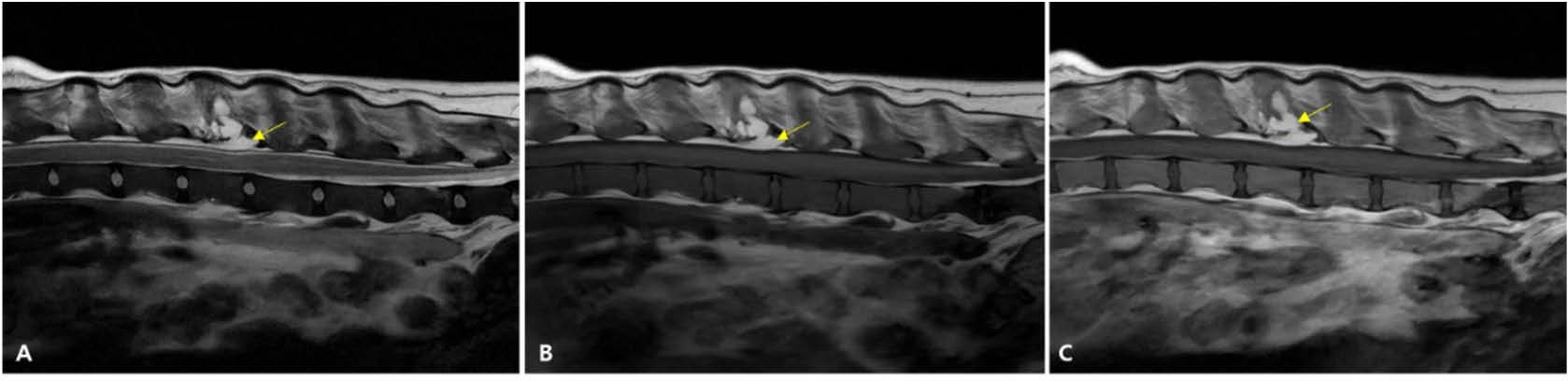
↑ 第395天L3-L4椎体水平的MRI。(A) T2加权图像(T2WI),(B) T1加权图像(T1WI),(C) 增强T1加权图像。经过治疗的L3肿块(A-C中的箭头)在T2WI和T1WI上均显示出高信号强度,符合脂肪特征,并且体积缩小。脊髓压迫几乎完全缓解。
尽管进行了支持性护理,包括处理尿功能障碍、疼痛控制、抗生素治疗和输血,但患者出现了发热和血便。该犬于第398天死亡。
05 讨论
多发性骨髓瘤(MM)是一种恶性浆细胞肿瘤,以浆细胞或其前体细胞的克隆性增殖和大量免疫球蛋白的产生为特征。在犬中,MM较为罕见,占所有恶性肿瘤的不到1%,占恶性造血肿瘤的不到10%。
该病的诊断通常依赖于组织病理学检查,但在某些情况下,也可以通过检测单克隆或双克隆免疫球蛋白、尿中游离轻链(Bence–Jones蛋白)、溶骨性病变或骨髓中浆细胞浸润超过20%等标准进行推断性诊断。
临床上,犬MM常表现为倦怠、虚弱、食欲减退等症状,骨髓受累可能导致贫血、血小板减少,骨溶解和骨侵犯可能导致疼痛、病理性骨折或神经功能障碍。此外,高黏滞综合征、高钙血症和凝血功能障碍等并发症也可能出现。
本病例描述了一只7岁的西高地白梗犬,被诊断为复发且难治性MM。该犬在接受了多种治疗方案后,包括传统的化疗药物(如美法仑、长春新碱、阿霉素和地塞米松)、放射治疗以及新型药物(如核输出抑制剂verdinexor、蛋白酶体抑制剂硼替佐米、卡非佐米和伊沙佐米,以及酪氨酸激酶抑制剂托塞拉尼和索拉非尼)后,病情仍逐渐恶化。
治疗过程中,verdinexor实现了最长的稳定缓解期且副作用较少,而硼替佐米虽然有效,但其毒性限制了长期使用。尽管进行了积极治疗,犬最终仍因高黏滞综合征的并发症死亡。
在治疗过程中,verdinexor作为一种新型的核输出抑制剂,首次被用于犬MM的治疗,并取得了较好的效果。然而,其抗肿瘤效果可能受到之前放射治疗或残留化疗活性的影响,因此需要进一步研究其在未接受细胞毒性化疗或放射治疗的犬MM中的单药疗效。
此外,硼替佐米作为一种蛋白酶体抑制剂,在人类MM治疗中已被广泛应用,但在犬中的应用仍处于探索阶段。本病例中,硼替佐米联合地塞米松的治疗方案在剂量≥1.45mg/m²时显示出一定的疗效,但由于累积的血液学和胃肠道毒性,限制了其长期使用。其他二线蛋白酶体抑制剂和酪氨酸激酶抑制剂在本病例中疗效有限。
本病例还强调了高黏滞综合征(HVS)在犬MM中的重要性。HVS是一种肿瘤学急症,由循环中细胞或蛋白质成分增加导致,可引起灌注受损、器官损伤和出血。
在本病例中,尽管尝试了紧急放血和红细胞输血,但由于缺乏快速的化疗减瘤反应,这些措施仅能提供短暂的益处。此外,由于缺乏组织病理学确认,本病例的诊断主要依赖于影像学和细胞学检查,这在一定程度上限制了诊断的确定性。
本病例展示了犬复发性、难治性MM的治疗潜力和临床挑战。虽然传统的MP和VAD方案仍然重要,但本病例的治疗选择基于患者的临床过程、对先前方案的耐受性和反应进行了调整。这种策略促进了新型疗法(如SINE、蛋白酶体抑制剂和TKI)的整合,超越了传统的兽医方案。
然而,由于缺乏先进的治疗手段(如自体干细胞移植、单克隆抗体和血浆置换),长期疾病控制受到显著限制。未来需要通过兽医肿瘤学的合作努力,建立基于证据的协议,以优化犬MM的诊断和新型治疗策略。
文献来源:Jang H, Jeong H, Sung AS, Kwon H, Sohn J, Kim JI, Choi MY, Huh C, Jung DI. Refractory Multiple Myeloma in a West Highland White Terrier: Clinical Presentations and Therapeutic Interventions. Animals. 2025 Aug 16;15(16):2405.