
慢性肾病(CKD)是一种常见疾病,影响1.4%的犬。CKD并非单一疾病,而是继发于多种感染性、炎症性、缺血性、梗阻性或家族性疾病过程,这些疾病会引发肾脏损伤或功能障碍。
通常无法确定CKD的引发因素,然而,一旦丢失了足够的功能性肾组织,肾脏对肾单位丢失的代偿机制会变得不适应,并促进CKD的进展,而与最初的损伤无关。
尽管CKD具有异质性,但已确定与疾病进展和存活相关的常见风险因素,包括血清肌酐、蛋白尿、高血压、高磷血症和不良体况评分等。因此,尽管CKD是一种不可逆的疾病,但在诊断时以及之后定期对患者进行适当分期非常重要,以便识别和治疗与进展相关的任何风险因素。这在疾病的早期阶段尤为重要,而在患有晚期CKD的患者中,治疗重点更多地放在管理因肾功能丧失导致的尿毒症并发症,如恶心和食欲不振。
01 诊断
CKD具有隐匿性,临床症状最初可能缺失或较轻,随着疾病进展逐渐变得明显。早期常见的临床症状包括多尿和多饮、体重减轻和食欲减退,随着肾功能恶化,还会出现倦怠和呕吐等其他症状。这些症状可能已经存在较长时间,才被带到兽医处就诊。
CKD的诊断通常基于脱水且稳定的患者持续升高的空腹血清肌酐,结合不适当的尿液稀释。在血清肌酐升高时,尿液比重小于1.030,符合犬的肾性氮质血症。血清肌酐浓度还受肾外因素的影响,如犬的品种、年龄和肌肉状况。因此,在解读血清肌酐时,重要的是要认识到实验室参考范围并非“一概而论”。
例如,接近参考范围上限的肌酐水平对于灰狗可能是正常的,但对于小型犬可能是肾小球滤过率(GFR)降低的指标。因此,与同一犬之前的测量值进行比较是非常有价值的,因为在CKD早期,肌酐的小幅增加可能代表肾功能的相对较大恶化,因为肌酐与GFR呈反比关系,即使肌酐仍在参考范围内。
对二甲基精氨酸(SDMA)是一种对肾功能较为敏感的指标,当肌酐水平仍在参考范围内,尤其是肌肉量显著减少时,其持续升高也与CKD一致。早期基于实验室犬的研究表明,SDMA可能是比血清肌酐更敏感的GFR降低的指标,然而,后续在临床患者中的研究并未一致证实这一点。
尽管成年犬SDMA的参考范围上限为14 μg/dL,但有研究建议,将18 μg/dL作为判断肾脏疾病的截断值可能更具特异性,因为一项研究中54%的SDMA大于14 μg/dL的犬并未显著降低GFR。
目前,SDMA用于检测CKD的诊断价值似乎与肌酐相似,最好将其作为诊断的辅助手段,结合其他临床数据(如肌酐和超声检查)一起考虑。与肌酐类似,SDMA也受非肾脏因素的影响,包括年龄、并发疾病(如肿瘤)以及品种(影响程度小于肌酐)。
作为功能性生物标志物,肌酐和SDMA只有在CKD相对进展到较晚期且肾脏内发生不可逆的病理改变时,才会高于参考范围。这促使人们寻找早期肾脏损伤的生物标志物,而一种新的肾小管损伤生物标志物——胱抑素B,最近已在英国商业上市。
目前,胱抑素B在CKD诊断中的临床应用价值尚不确定,但它可能有助于区分患有非氮质血症性CKD的犬,其中一些犬会继续出现进行性肾功能障碍,而另一些犬的肾功能则保持稳定。
患者也可以根据肾脏触诊或影像学检查发现的异常、持续性肾性蛋白尿,或在没有肾前性原因的情况下,肌酐/SDMA在参考范围内升高来诊断非氮质血症性CKD。
除了肌酐和SDMA升高外,实验室检查通常还会发现其他异常,包括尿素升高、高磷血症、钙和钾紊乱、代谢性酸中毒以及非再生性贫血。影像学检查通常显示非特异性变化,因此往往没有太多收获,但在超声检查中可能会观察到肾脏缩小,以及皮髓质分界和实质回声的变化。
02 CKD的分期与亚分期
一旦确诊为CKD,其严重程度可以根据国际肾脏兴趣协会(IRIS)的分期系统,依据空腹血清肌酐浓度进行分类(表1)。在存在显著肌肉消耗的情况下,SDMA可能是反映真实IRIS分期的更可靠的指标,当肌酐和SDMA持续不一致时,患者应被归入较高的分期。随后,患者可以根据是否存在蛋白尿和高血压进行亚分期。
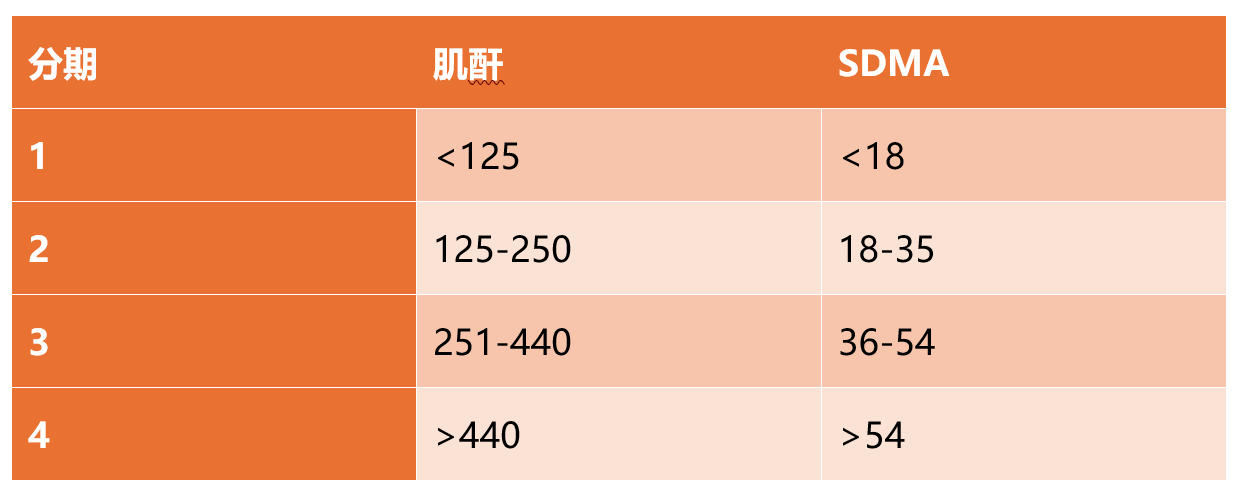
表1. IRIS对犬CKD的分期。
蛋白尿具有预后意义,也是治疗目标,通过测量尿蛋白与肌酐比值(UPC)来评估蛋白尿,比使用尿试纸条等不太精确的方法更为理想。在犬中,蛋白尿定义为UPC大于0.5,而UPC在0.2–0.5之间被认为是临界蛋白尿。
理想情况下,应基于至少两周内收集的两次UPC测量值对犬进行亚分期,以确认蛋白尿的持续性,尤其是当UPC值接近0.5的临界值时。UPC本质上具有生物学变异性,虽然随机样本可以提供蛋白尿程度的可接受指示,但三个混合尿液样本的UPC可能更为准确,特别是在蛋白尿程度较高的患者中。
主人应在家中每天收集一次自由采样的尿液样本,连续三天,并将样本存放在冰箱中。从每个样本中取等量体积的尿液,混合在一个新鲜的尿液容器中,然后送检进行UPC测量。
UPC还可能受到肉眼血尿的影响,并且在不同程度上受到脓尿和菌尿的影响,因此应同时进行尿沉渣检查,以排除肾后性蛋白尿。
在原发性肾小球疾病中,蛋白质通过受损的肾小球漏出,超过了肾小管上皮细胞的重吸收能力。在患有肾小管间质疾病的犬中,近曲小管上皮细胞重吸收小分子蛋白质的能力降低。蛋白尿的严重程度越高,肾小球疾病存在的可能性就越大。
UPC大于2.0通常被认为是提示肾小球性而非肾小管性蛋白尿的水平,并且可能与蛋白丢失性肾病(PLN)相关。对于这些患者,应根据犬所在或曾到访的地理区域进行适当的传染病检测。
在英国,这可能包括对伯氏疏螺旋体(Borrelia burgdorferi)和嗜吞噬细胞无形体(Anaplasma phagocytophilum)的检测,但如果患者曾前往其他地区,检测范围应扩大,例如对于来自或曾到访南欧的患者,应包括利什曼原虫(Leishmania)的血清学检测。
对于肾功能稳定的患者,如果仅有轻度蛋白尿且没有相关疾病过程的迹象,可以考虑在此阶段停止进一步检查,并对蛋白尿进行对症治疗。对于蛋白尿较显著(UPC大于3.5)、蛋白尿进行性加重或低白蛋白血症的患者,则需要进一步检查。
胸部和腹部影像学检查可用于识别任何引发炎症、感染或肿瘤的过程,但如果这些检查结果无异常,则患有PLN的患者最终需要通过肾脏活检进行组织病理学评估以明确诊断。
只有当检查结果可能改变患者治疗方案时,才建议进行肾脏活检,这主要适用于有显著蛋白尿和低白蛋白血症且轻度或无氮质血症的患者,其中免疫复合物性肾小球肾炎(ICGN)是潜在的诊断。对于已进展至终末期肾病的患者或以氮质血症为主要特征且仅有轻度蛋白尿的CKD患者,肾脏活检是禁忌的。
高血压在患有CKD的犬中很常见,其发病率根据所研究的群体和高血压的定义不同,报道为9%-93%。所有被诊断为CKD的犬都应该在确诊时评估是否存在高血压,之后每三到六个月评估一次。目前美国兽医内科协会(ACVIM)的共识指南包括一个基于靶器官损伤(TOD)风险的高血压诊断分类系统(表2)。
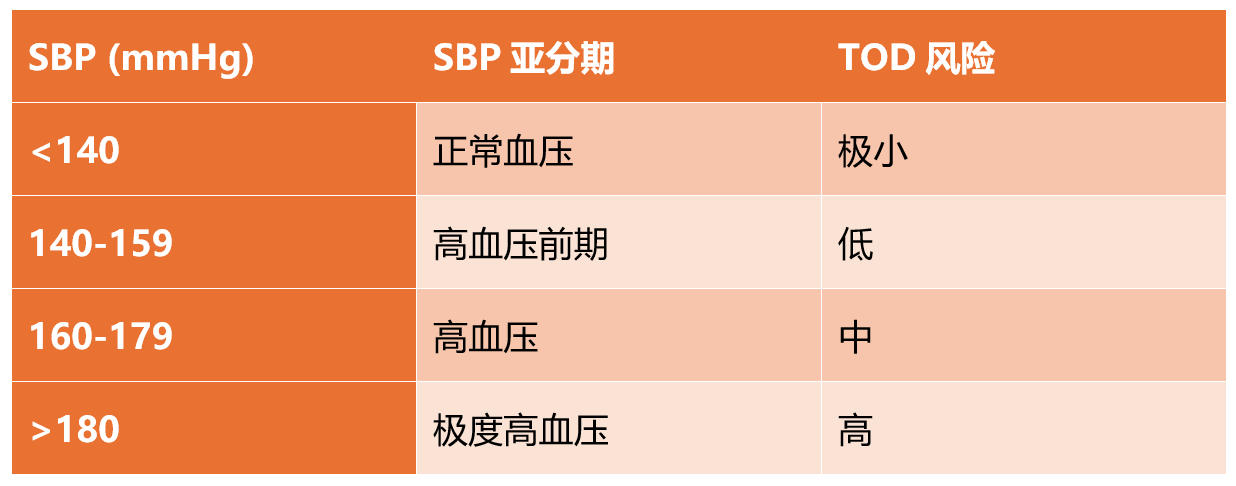
表2. 根据ACVIM关于犬猫系统性高血压的识别、评估和管理共识声明指南,收缩压(SBP)根据TOD风险进行分类。
疑似高血压的犬应进行眼底镜检查,以评估是否存在眼部TOD,例如视网膜出血和大泡性视网膜脱离。如果存在TOD,一次血压测量就足以确认诊断。然而,如果TOD不明显,则需要在至少两次不同时间(间隔至少7-14天)进行重复血压测量。对于确诊的高血压TOD患者,或收缩压(SBP)持续达到或超过160 mmHg的患者,应开始治疗。
血压测量方法如下:
-血压应在安静的区域、远离其他动物的地方测量。患者应有5-15分钟的时间适应环境。在进行任何其他侵入性操作(如采血)之前应测量血压。如果需要保定,应尽量减少。理想情况下,患者应处于侧卧或俯卧位。
-应选择合适的血压袖套——理想情况下,袖套的宽度应为腿部或尾部周长的30%-40%。
-应丢弃第一次测量结果,并获取5-7次连续测量的平均值。
-书面记录应包括袖套的大小和位置、数值和结果。
03 治疗
CKD是一种进展性疾病,目前尚无治疗方法能够逆转肾功能的下降。CKD的管理目标因IRIS分期(表3)而异,包括避免使用肾毒性药物、维持血清磷浓度在目标范围内、治疗蛋白尿以及管理CKD的后果,如恶心和贫血。
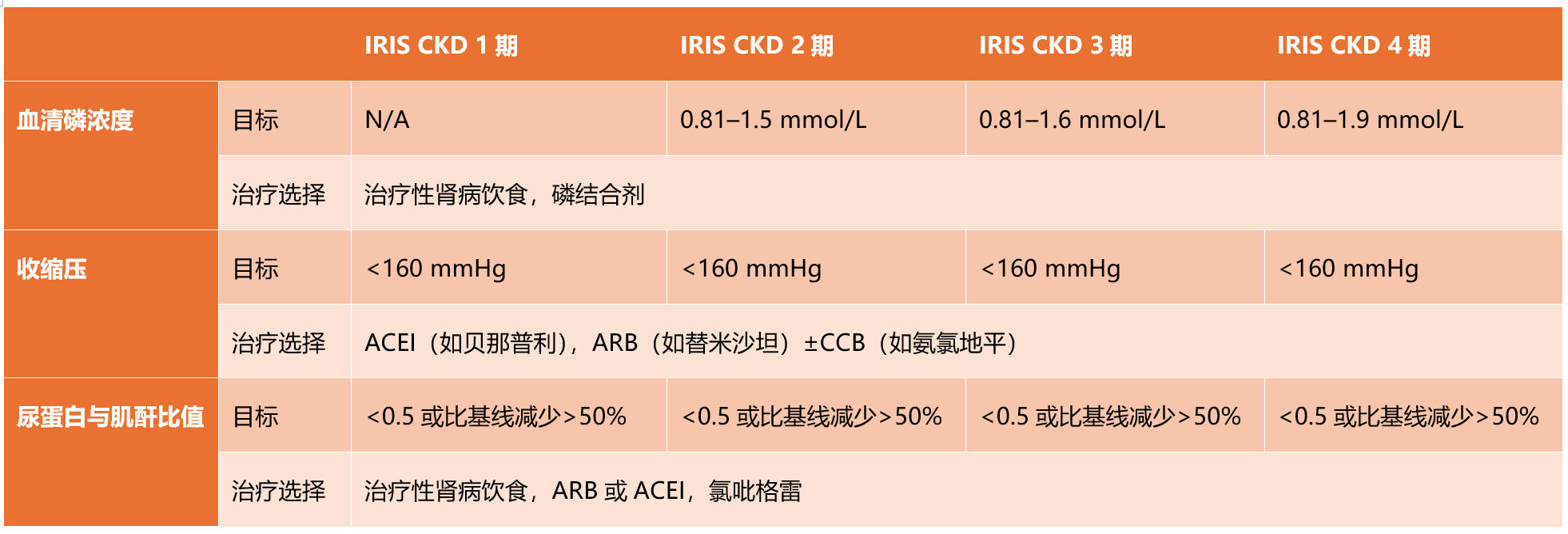
表3. 根据IRIS疾病分期,犬CKD的管理目标。
与宠物主人进行有效沟通至关重要,治疗计划应根据患者和主人的需求进行个性化调整。重要的是要考虑患有CKD的犬主人的护理负担,以实现最佳的主人依从性。应经常与主人一起回顾治疗和监测计划,以确保其可持续性和可负担性。还必须定期评估患者的生活质量。
1. 治疗目标
(1)避免使用肾毒性药物
肾脏是许多药物排泄的主要途径,因此药物及其代谢产物的高浓度可能在肾脏中积累并造成进一步损伤。潜在的肾毒性药物包括顺铂、非甾体抗炎药(NSAID)以及某些抗生素,如氨基糖苷类、四环素类和磺胺类。
非甾体抗炎药通过抑制环氧合酶(COX1和COX2)来抑制前列腺素的产生,常用于治疗骨关节炎,而骨关节炎是患有CKD的老年患者中常见的合并症。
前列腺素在肾脏的肾小管功能和血管张力中起着重要作用。在肾功能受损的犬中,抑制这些酶可能会导致肾灌注减少和肾小管功能降低。然而,这主要是在体液不足的状态下,如脱水或低血容量时才会引起关注。
在猫中,长期口服美洛昔康似乎并不会缩短已有稳定CKD的猫的寿命,即使对于IRIS 2期和3期的猫也是如此。对于患有晚期CKD的犬,应考虑其他疼痛管理方法,包括使用其他镇痛药和物理治疗。然而,通过从较低剂量开始,已成功地在许多患有CKD的犬中使用了NSAID。
(2)饮食
营养在犬CKD的管理中起着至关重要的作用。商业性肾病饮食含有有限量的磷、适量的高质量蛋白质、增加的热量密度、增加的ω-3多不饱和脂肪酸,并且对酸碱平衡的影响应为中性。
这些饮食被配制得非常可口,并且有各种形式可供选择,以增加接受度。如果患者对某一特定肾病饮食产生反感,建议尝试其他品牌。许多患者会轮换使用各种品牌和形式的肾病饮食。这些饮食的湿式与干式配方的选择通常取决于患者的偏好。
湿性食物可能有助于那些不愿意喝水的犬改善水合状态。如果患者或主人对商业性饮食的依从性较差,可以咨询认证的兽医营养师,以提供关于自制饮食的指导。如果患者拒绝所有商业和自制的肾病饮食选择,可以考虑使用平衡的商业饮食。
(3)治疗恶心症状
恶心和食欲不振是患有CKD的犬常见的临床症状,可能会导致体重减轻。流涎、食欲不振和腹部不适可能是犬恶心的迹象。不良的体况与预后较差有关。食欲也是生活质量的一个重要指标。
恶心和食欲不振的症状可能会时好时坏,因此主人备有一些适当的药物以便按需使用是有帮助的。止吐药在减少与CKD相关的呕吐方面发挥着重要作用,如果它们能针对恶心,可能有助于改善食欲。
口服马罗吡坦和昂丹司琼常用于治疗患有CKD犬的恶心发作。米氮平是一种四环类抗抑郁药,作为食欲刺激剂在犬中使用,效果各异。卡普瑞林是一种生长素激动剂,最近已作为犬的食欲刺激剂上市,可能有助于管理厌食发作。
质子泵抑制剂(奥美拉唑)和H2受体拮抗剂(法莫替丁、雷尼替丁)等胃酸抑制剂不建议常规用于患有CKD的犬。胃酸抑制剂会增加主人的护理负担,对胃肠道微生物群产生负面影响,且长期使用与人类钙稳态失调有关。这些药物仅应在有胃肠道出血(黑便、缺铁性贫血)或因呕吐引起的食管炎证据的患者中考虑使用。
(4)蛋白尿的管理
蛋白尿与患有CKD的犬预后较差有关。蛋白尿性CKD的管理包括使用血管紧张素转换酶抑制剂(ACEI),如贝那普利和依那普利,或血管紧张素受体拮抗剂(ARB),如替米沙坦,抑制肾素-血管紧张素-醛固酮系统(RAAS),同时通过饮食管理优化饮食中的蛋白质和多不饱和脂肪酸(PUFA),通常是通过喂食商业治疗性肾病饮食。
与依那普利相比,替米沙坦与更快且更显著的UPC降低相关,因此在治疗犬的蛋白尿方面,ARB优于ACEI。由于RAAS抑制会导致出球小动脉收缩,患者应密切监测氮质血症的恶化和电解质紊乱,且在低血容量或脱水的患者中不应开始使用ACEI/ARB。
在开始使用RAAS抑制剂后,以及在任何剂量调整后,患者应在一周后进行临床检查、重复血清肌酐和电解质测量以及血压监测。虽然在抗蛋白尿治疗开始时,血清肌酐浓度可能会有轻微升高,但如果氮质血症显著恶化(肌酐增加超过30%)或出现高钾血症,应减少剂量或更换其他RAAS抑制剂。
尽管ACEI和ARB的联合治疗已被证明比单一治疗更能降低蛋白尿,但也与氮质血症恶化和电解质失衡的更高风险相关,因此不推荐使用。
在开始RAAS抑制治疗后三到四周应重新检测UPC。治疗目标是使UPC降至小于0.5,尽管对于严重蛋白尿的犬来说,更现实的目标是从基线UPC减少至少50%。
如果未达到治疗目标,则应将RAAS抑制剂的剂量增加0.5 mg/kg/天,并在一周后以及三到四周后再次进行监测。如果出现氮质血症或高钾血症,应将剂量恢复到最后的安全剂量。患有PLN(持续UPC至少为0.5)的犬可能会发生血栓栓塞性疾病,建议这些患者使用氯吡格雷进行抗血栓治疗。
(5)高血压的管理治疗
高血压的目标是逐渐降低血压,以减少TOD的风险。系统性高血压还会导致蛋白尿,应在受影响的患者中进行管理。应至少将SBP降至160 mmHg以下,而140 mmHg被认为是理想的。如果高血压控制不佳,应根据表4中的指导增加抗高血压药物的剂量。
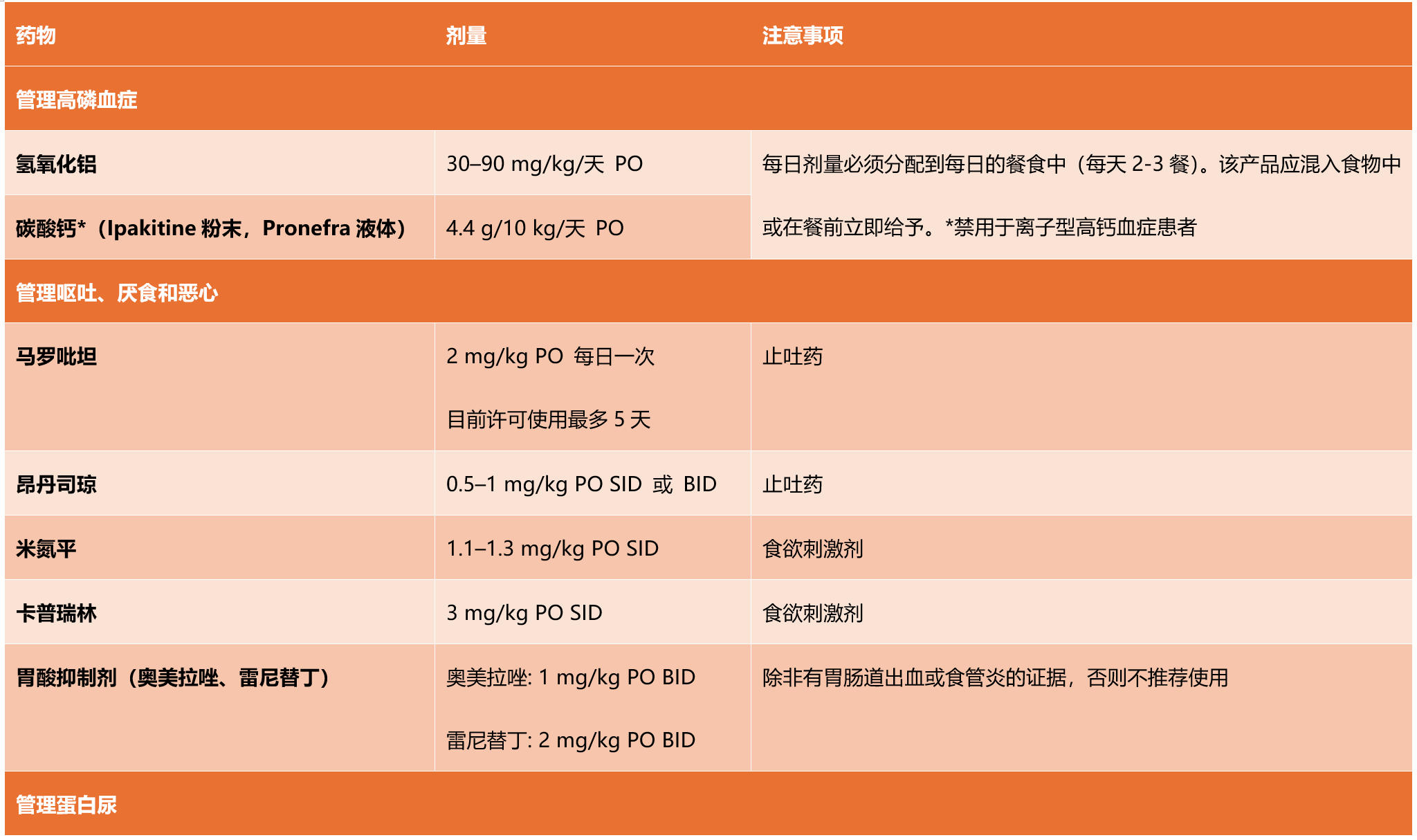
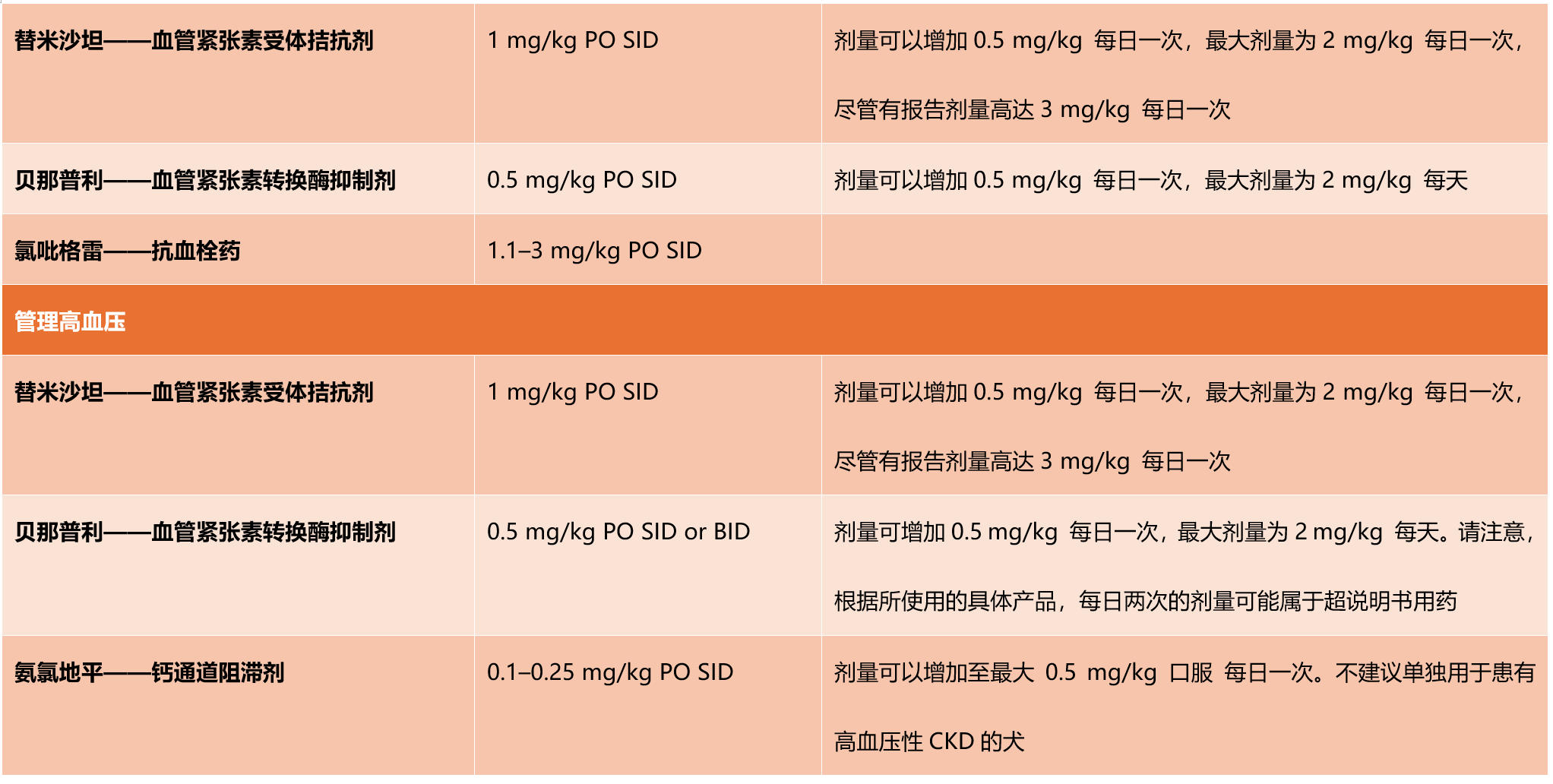
表4. 犬慢性肾病常用药物。
RAAS抑制剂是较弱的抗高血压药物,但由于其抗蛋白尿作用,通常建议作为患有高血压和CKD犬的首选药物。在严重高血压的犬(SBP至少为200 mmHg)中,RAAS抑制剂可以与钙通道阻滞剂(CCB,如氨氯地平)联合使用。
CCB主要扩张肾入球小动脉,这会导致肾血流自动调节功能丧失,可能会使肾小球暴露于肾小球内压的有害增加和氮质血症的恶化。因此,不建议将CCB单独用于患有高血压性CKD的犬。如果SBP降至120 mmHg以下,并且出现低血压的迹象,如虚弱或晕厥,则应减少抗高血压药物的剂量。
(6)贫血的管理
促红细胞生成素(EPO)在肾脏中产生,可刺激红细胞的生成。随着肾功能的下降,EPO水平降低,导致慢性轻度非再生性贫血。胃溃疡在患有CKD的犬中并不常见,但需要排除其作为贫血急性加重或缺铁证据患者的可能原因。
对于患有CKD且有贫血临床症状(倦怠、黏膜苍白)和红细胞压积(PCV)高达20%的犬,应使用促红细胞生成刺激剂进行治疗。人EPO与产生抗促红细胞生成素抗体有关,这些抗体会与患者自身的内源性EPO发生交叉反应,从而导致贫血加重。
达依泊汀是促红细胞生成素的一种合成类似物,不太可能引起抗促红细胞生成素抗体。达依泊汀通过皮下注射给药(0.25–1 μg/kg,每周一次),直至PCV大于30%或比基线增加了超过10%,然后可减少给药频率以维持PCV在目标范围内。
铁是红细胞生成所必需的,在达依泊汀治疗期间应补充铁。可以考虑口服铁补充剂(硫酸亚铁100–300 mg,每24小时口服一次),但铁片口感不佳,对于食欲不振的动物,依从性可能较差,因此建议使用肌肉注射(右旋糖酐铁10–20 mg/kg,每月一次)。患者应监测高血压,这是达依泊汀的潜在副作用(图1)。

图1. 使用多普勒超声设备测量血压。
(7)CKD矿物质骨病
肾脏在成纤维细胞生长因子23(FGF-23)、甲状旁腺激素(PTH)和骨化三醇等激素的影响下,在钙和磷的稳态中起着重要作用。随着肾功能的下降,这些机制变得失调。
在CKD早期,磷的排泄开始减少,血清磷升高导致FGF-23产生增加,FGF-23的作用是增加肾脏磷的排泄。然而,随着CKD的进展,这种机制被压倒,持续的高磷血症刺激PTH释放,导致肾性继发性甲状旁腺功能亢进。
在犬中,随着IRIS CKD分期的增加,肾性继发性甲状旁腺功能亢进的患病率和严重程度增加。慢性肾性继发性甲状旁腺功能亢进可导致骨矿物质流失,在犬中,这可能导致上下颌骨的纤维性骨营养不良。
商业治疗性肾病饮食限制磷的摄入,以补偿磷排泄的减少,并可维持血清磷在目标范围内(表3)。在转换到新饮食后四到六周应监测血清磷。如果仅靠饮食无法达到IRIS对CKD每个阶段的血清磷浓度目标,则建议添加肠道磷结合剂(表4)。
磷结合剂在胃肠道内结合磷,抑制其吸收,重要的是要向主人解释,结合剂必须与每餐一起服用才能有效。铝基磷结合剂通常耐受性良好且安全,但口感不佳。
钙基结合剂对磷的亲和力较低,需要更高的剂量。钙基结合剂也禁用于离子型高钙血症患者。镧盐和司维拉姆碳酸盐是其他磷结合剂,但价格昂贵,在兽医学中很少使用。应根据血清磷的监测结果有效使用磷结合剂。
不幸的是,维持性饮食含有高磷,而仅仅在患者的常规饮食中添加磷结合剂并不能始终纠正高磷血症。目前已有多种功能饮食(例如,皇家卡尼多功能肾病+低过敏性饮食)可供具有复杂饮食需求的患者选择。
04 预后
尽管CKD是一种不可避免的进展性疾病,但患有CKD的犬很少会出现肾功能的线性下降,它们可能会经历一段病情稳定期,随后突然恶化。
在一项针对27只犬的小型研究中,IRIS 2期CKD犬的中位生存时间为15个月,IRIS 3期CKD犬为11个月,IRIS 4期CKD犬为2个月。值得注意的是,这些生存时间存在很大差异,这表明患有CKD的犬的预后结果存在相当大的变化。
文献中存在相互矛盾的报告,但血清磷浓度升高、蛋白尿、系统性高血压、低体况评分、低肌肉状况评分以及钙磷乘积增加均已被证明是CKD的不良预后指标。然而,很难预测单个受影响犬的预后。通过兽医团队与主人的合作,成功管理CKD及其相关共病,可以延缓疾病进展并改善患者的生活质量。
参考文献:Mullowney, D. and Lawson, J. (2025), Diagnosis and treatment of chronic kidney disease in dogs. In Practice, 47: 276-286.