
| 一般情况 | |
 | 品种:马尔济斯犬 |
| 年龄:11岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:皮肤肠瘘 | |
01 主诉及病史
因持续呕吐、厌食和倦怠5天就诊。
02 检查
体重2.9公斤。表现倦怠,但生命体征未发现其他异常。血常规显示白细胞增多,其中中性粒细胞增多(白细胞27950/µL [5050-16760];分叶核中性粒细胞24330/µL [2950-11640];单核细胞1560/µL [160-1120])。
生化显示淀粉酶和脂肪酶分别升高至5932 U/L [500-1500]和7382 U/L [200-1800]。碱性磷酸酶轻度升高至285 U/L [23-212],其他生化指标正常。血清犬胰脂肪酶(cPL)超过1000.00 ng/mL [200-400],D-二聚体水平升高至2087.87 ng/mL [50-250]。
腹部超声发现胃窦至十二指肠降部近端有明显声影,提示可能存在异物,并伴有肠段扩张。超声还显示胰腺增厚且呈低回声,需考虑急性胰腺炎等鉴别诊断。
03 治疗
决定进行剖腹探查术以移除异物。
术前用药包括头孢曲松(30 mg/kg,IV)用于抗菌预防,布托啡诺(0.1 mg/kg,IV)用于镇痛。还给予马罗吡坦(1 mg/kg,IV)和法莫替丁(0.5 mg/kg,IV)用于止吐和胃部保护。
使用咪达唑仑(0.3 mg/kg,IV)和丙泊酚(4 mg/kg,IV)诱导全身麻醉,随后用异氟醚在100%氧气中维持麻醉。在手术过程中最初使用芬太尼用于镇痛,但由于出现心动过缓和低血压,迅速停用。选择布托啡诺作为更安全的术中镇痛替代药物。
实施了正中腹壁切开术,发现异物呈线状,从胃部延伸至空肠。进行了胃切开术以移除卡在胃内的异物。另外进行了单独的空肠切开术,以取出位于十二指肠和近端空肠的剩余部分。
取出的异物为一个长约50厘米的紧密线状物体,由卫生棉条和湿巾组成。切除了一段长约5厘米的坏死空肠。胰腺弥漫性水肿,符合急性胰腺炎。胃切开术部位用4-0缝线缝合,黏膜下层采用简单连续可吸收缝合,浆肌层采用反转Cushing缝合模式。
用4-0缝线以简单间断模式进行端到端肠吻合,肠系膜用4-0缝线以简单连续模式缝合。将大网膜覆盖在吻合部位,以提供额外的血管支持并促进愈合。
鉴于胃食管连接部和胃底观察到的广泛黏膜损伤——表现为严重的出血和炎症,且有穿孔的高风险——以及同时怀疑的急性胰腺炎,选择经空肠造瘘管进行早期术后肠内营养,同时绕过上消化道。
放置了一根6号空肠造瘘管。在右侧腹壁用15号刀片做一个切口,分离一段近端空肠。在肠系膜对侧边缘做一个切口,将喂养管的远端通过切口插入,向远端推进15厘米。用荷包缝合固定管子。然后进行空肠固定术,即从空肠到腹壁创建两个完整的缝合包,将空肠造瘘管包裹在内(下图)。
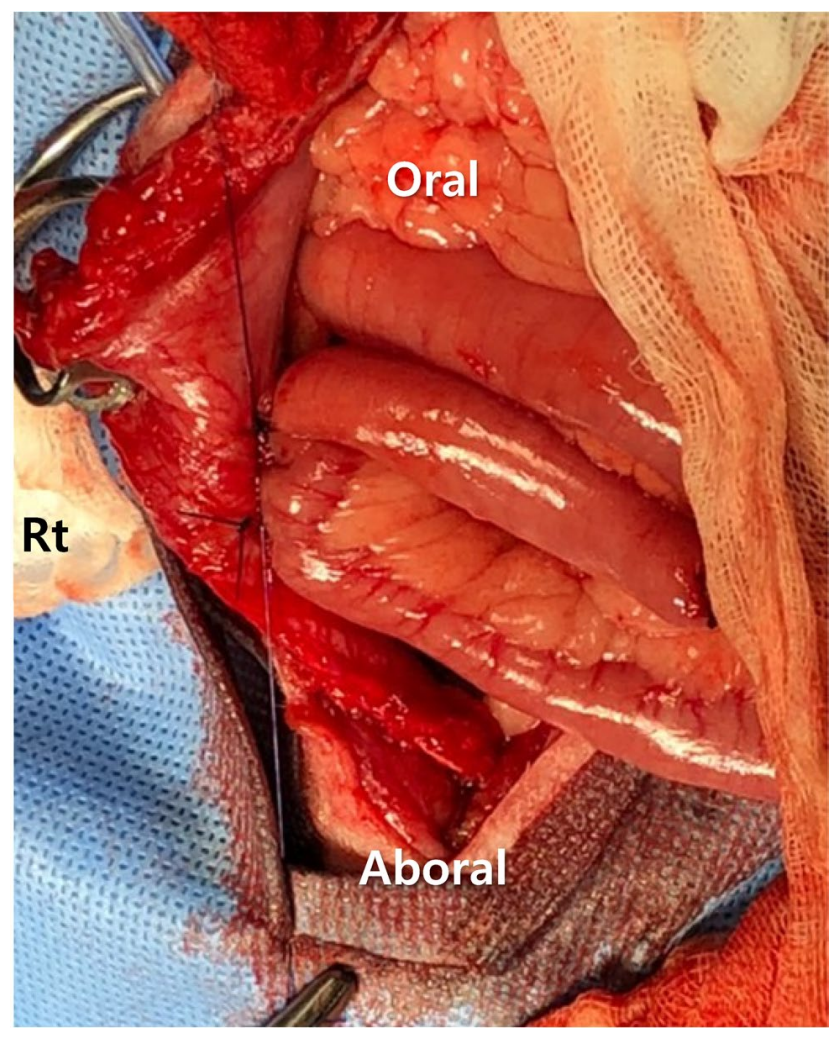
↑ 空肠造瘘管从空肠放置到腹壁。
术后,通过空肠造瘘管以3 mL/h的速率以持续输注的方式开始肠内营养,使用液体饮食。在最初的两天内,逐渐将喂养速率增加到5 mL/h,同时监测胃肠道耐受性。
患者术后住院三天。住院期间,使用布托啡诺持续输注镇痛,随后改为每日四次IV。为了经验性抗菌治疗,使用了广谱抗生素,包括头孢曲松(30 mg/kg,每日三次,IV)、恩诺沙星(20 mg/kg,每日一次,IV,持续1小时)和甲硝唑(15 mg/kg,每日两次,IV,持续30分钟)。
为了减轻胃肠道风险并促进黏膜保护,给予泮托拉唑(1 mg/kg,每日两次,IV)、米索前列醇(3 mcg/kg,每日两次,PO)和硫糖铝(500 mg/kg,每日两次,PO)。还使用了马罗吡坦(1 mg/kg,每日一次,IV)和昂丹司琼(0.5 mg/kg,每日两次,IV)。
胰腺炎的支持治疗包括液体疗法,将以下辅助药物加入500 mL平衡晶体溶液中:加贝酯美司钠(5 mg/kg/h,IV)、乌司他丁(25,000 U/kg,IV)、维生素B(1瓶,2 mL/瓶)、维生素C(1瓶,100 mg/瓶)、牛磺酸(5 mL)和保肝药物(5 mL)。
04 预后
术后未出现呕吐,同时开始重新引入口服食物,与空肠造瘘管喂养相结合,以满足静息能量需求。
恢复顺利,术后第3天出院,口服药物包括头孢克肟、恩诺沙星、甲硝唑、奥美拉唑、硫糖铝和甲氧氯普胺。在家期间临床状况改善,未报告并发症。
术后第4天,食欲正常,无呕吐,且行为状态有所改善。
术后第5天,恢复完全口服摄入,未出现并发症。移除了空肠造瘘管。剖腹探查术切口和空肠造瘘术切口均愈合良好。
术后两周,手术切口和空肠造瘘管移除部位均无异常。
术后1个月,临床稳定,未出现胃肠道症状复发。
术后4个月,因中后腹壁局部蜂窝织炎再次就诊,表现为红斑、肿胀和脓性分泌物。之前的空肠造瘘术部位出现裂开,使用了敷料进行局部伤口护理,同时给予头孢克肟(12.5 mg/kg,每日两次,PO)进行为期两周的抗生素治疗。尽管采取了这些措施,但该病变仍持续产生血性或脓性分泌物,遂再次就诊。
05 再次就诊
除了皮肤病变外,临床状况良好。体温38.4℃,收缩压150 mmHg,无脱水迹象,黏膜呈粉红色,毛细血管再充盈时间在2秒以内。心脏听诊未发现异常,心率132次/分钟,且有间歇性喘息。还发现中腹部皮肤变薄且裂开,呈现为一个直径为1厘米的圆形瘘管,并有少量血性分泌物(下图)。
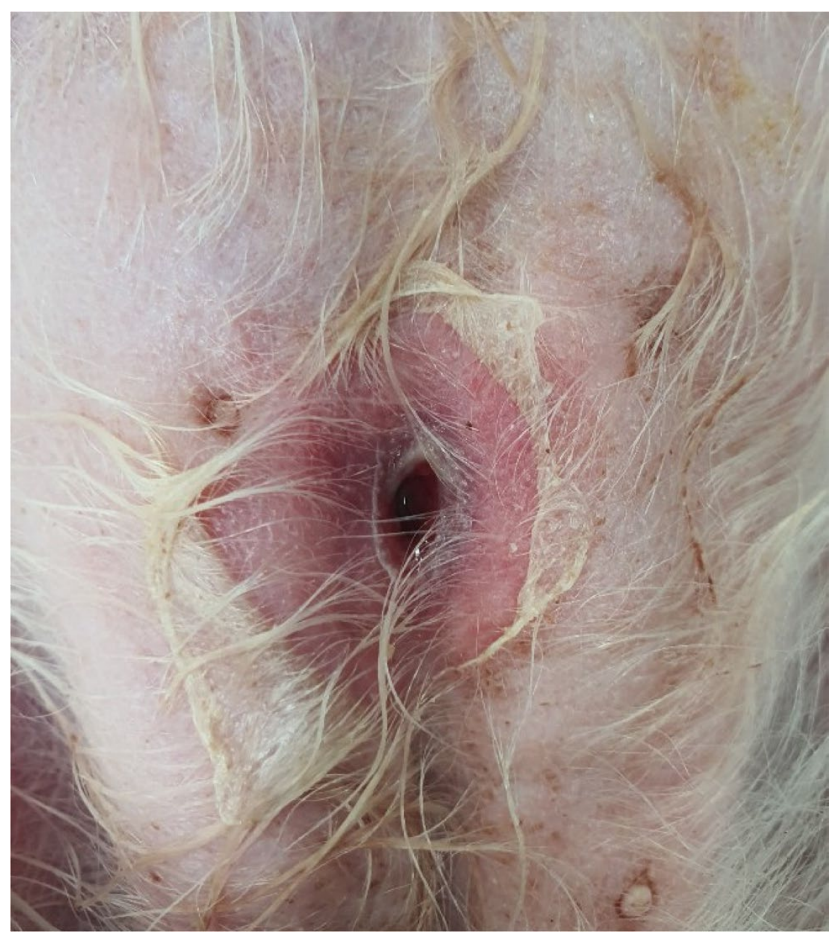
↑ 皮肤裂开,直径1厘米,瘘管有少量血性分泌物。
血常规显示红细胞轻度减少(4.84×10⁶/µL [5.65-8.87])、红细胞比容(32.2% [37.3-61.7])和血红蛋白(11 g/dL [13.1-20.5])。中性粒细胞和白细胞总数均在参考范围内。血生化未见异常,但碱性磷酸酶显著升高,达到685 U/L [23-212],与四个月前相比显著上升。
进行了促肾上腺皮质激素刺激试验,显示基础皮质醇浓度为2.4 µg/dL [0.5-10],刺激后皮质醇浓度超过30 µg/dL [6-18],提示可能患有肾上腺皮质功能亢进。皮肤病变的涂片细胞学检查发现大量过度分叶的中性粒细胞,其中一些显示出吞噬杆状细菌,还有散在的单核细胞和巨噬细胞。
超声显示肾上腺大小在参考范围内:左侧3.9/3.7 mm,右侧3.1/3.9 mm(头端/尾端)。腹部皮肤缺损的超声确认其通过皮下组织和腹壁与一个梭形低回声区域相连,该区域大小为28.1 mm,内含强回声物质并伴有声影。确认了低回声区域在皮下和腹壁层与邻近空肠段相连,且缺乏正常的肠壁分层,腹侧的肌层显著增厚。
进行了瘘管造影以确定瘘管的起源和通畅性。瘘管造影时,将一根24G套管针插入瘘管,并在透视下缓慢注入约3 mL碘海醇。透视显示造影剂从皮下和腹壁层通过腹壁进入邻近肠腔(下图)。这些发现最终确诊为肠皮肤瘘。尽管建议进行CT以评估肠与腹壁之间的粘连程度,但由于主人的经济限制,未进行该检查。
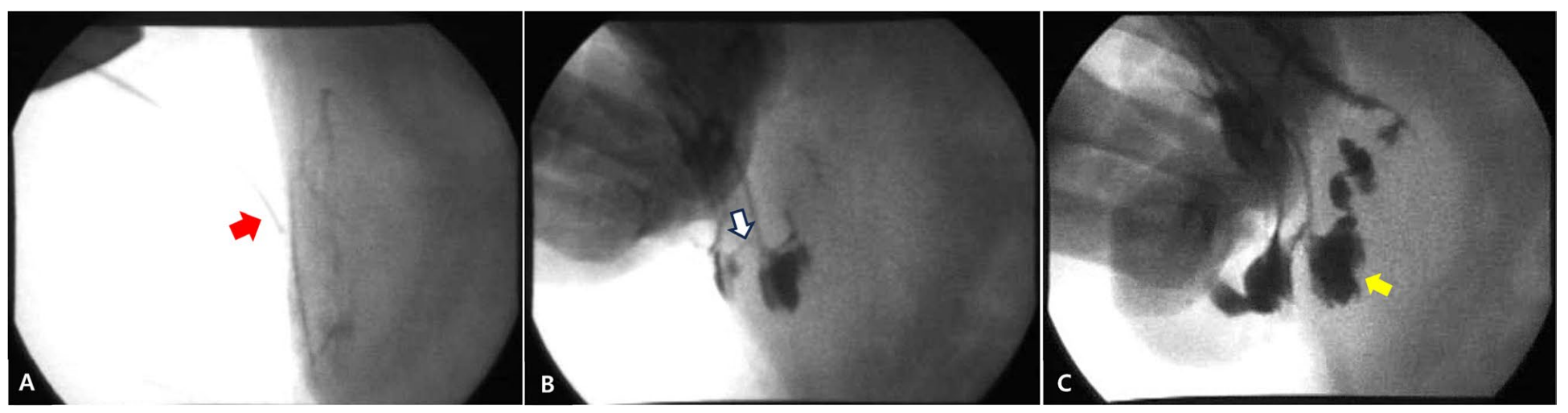
↑ A. 用于瘘管造影的套管针(红色箭头)已放置。B. 通过皮肤瘘管通道注入碘海醇(白色箭头)。C. 在空肠肠腔内发现碘海醇(黄色箭头)。
06 二次手术
为了清除坏死组织并切除肠皮肤瘘,通过瘘口部位的正中腹壁切口进行了剖腹探查术。麻醉方案与之前的手术相同。
观察到之前手术的空肠固定术部位已完全与腹壁粘连(下图A),确保肠内容物不会泄漏到腹腔内。通过钝性和锐性分离的结合,仔细地将空肠和腹壁彼此分离。识别出连接腹壁和空肠的瘘管开口(下图B)。瘘管及其周围的慢性退行性组织占据了肠周长的一半左右(下图C),因此在清除坏死组织后进行的一期修复很可能会导致局部肠腔狭窄的高风险。
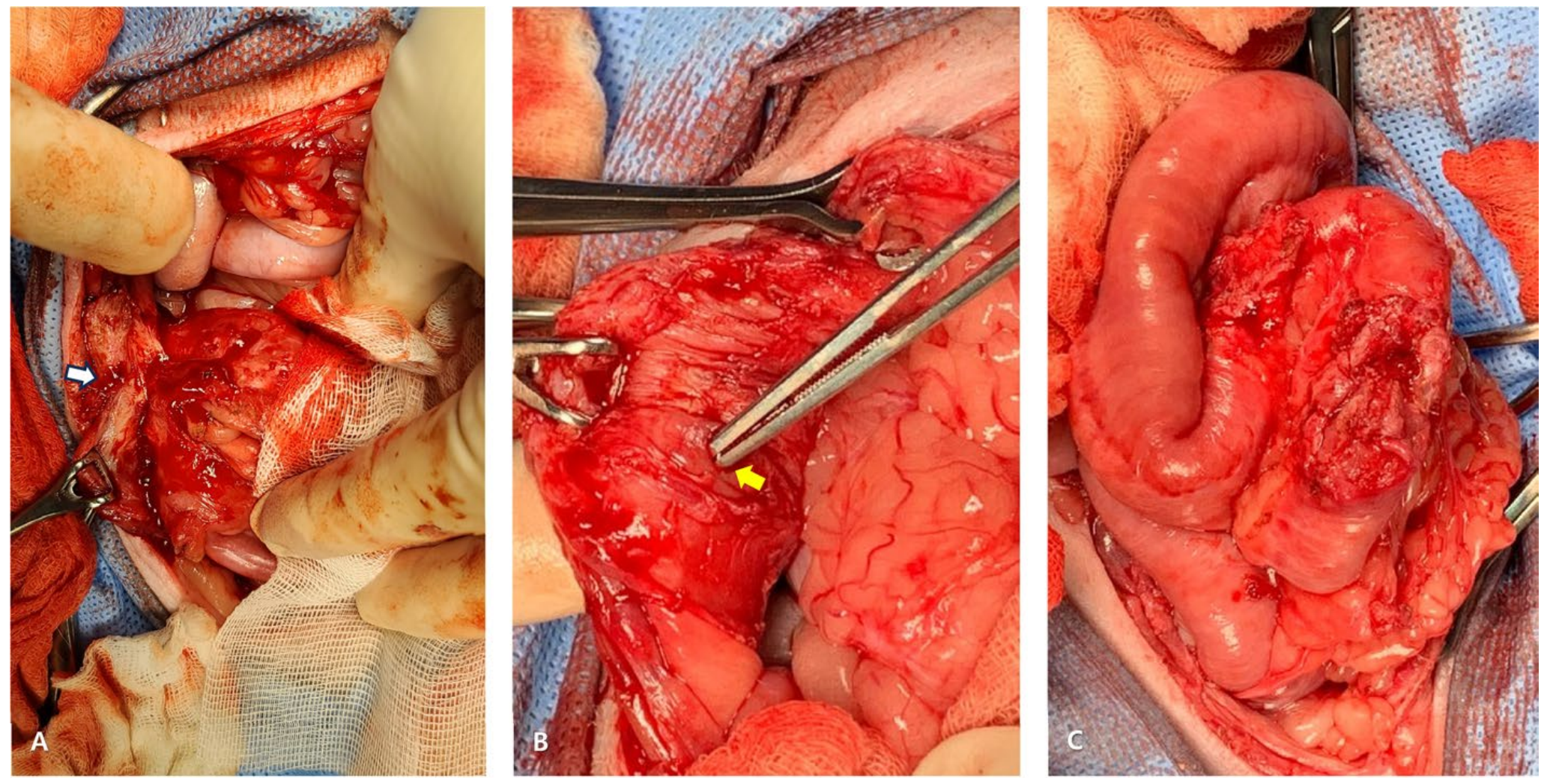
↑ A. 空肠固定术部位,空肠与腹壁粘连(白色箭头)。B. 在腹壁中识别出肠皮肤瘘(黄色箭头)。C. 在肠壁中识别出肠皮肤瘘及慢性退行性组织。
因此,对受影响的空肠段进行了肠切除,随后使用4-0缝线以简单连续模式进行了端到端吻合。在用足够的生理盐水冲洗并进行漏液测试后,应用了网膜补片。收集受影响腹壁的组织样本进行细菌培养,并切除和清除了瘘管组织。由于主人的经济限制,未进行组织病理学分析。
腹壁用3-0缝线以简单连续模式缝合。皮下层和真皮层用4-0缝线以简单连续模式对齐,皮肤用3-0聚酰胺缝线以间断缝合模式缝合。该犬从麻醉中顺利恢复。
术后管理包括静脉注射头孢曲松(30 mg/kg,q8h)和甲硝唑(15 mg/kg,每日两次),持续四天,同时口服奥美拉唑(1 mg/kg,每日两次)和曲洛斯他酮(1 mg/kg,每日两次)。鉴于存在肠皮肤瘘以及潜在的微漏或厌氧菌污染风险,术后使用甲硝唑以提供额外的厌氧菌覆盖。
在第二次手术中,考虑到之前芬太尼引起的心血管不良反应,术前镇痛再次使用布托啡诺。然而,在术后期间,芬太尼枸橼酸盐(2 µg/kg负荷剂量,随后以12 µg/kg/h维持12小时)重新用于术后疼痛控制。在此期间未观察到心动过缓或低血压的复发,芬太尼在整个住院期间耐受性良好。
瘘管组织的细菌培养鉴定出奇异变形杆菌和大肠杆菌,这两种菌均对头孢曲松和头孢克肟敏感。根据细菌培养结果,停用甲硝唑,并继续以头孢克肟单药治疗五天。术后,患者的食欲正常,未出现胃肠道症状。
07 预后
术后第3天出院,口服药物包括曲洛斯他酮(1.2 mg/kg,每日两次)、头孢克肟(5 mg/kg,每日两次)、甲硝唑(15 mg/kg,每日两次)和奥美拉唑(1 mg/kg,每日一次)。
术后第6天和第10天,患者食欲良好,活动正常,手术部位愈合良好。
术后第14天,拆除外部皮肤缝线,未观察到任何并发症。
术后4周,促肾上腺皮质激素刺激试验显示刺激后的皮质醇浓度为8.9 µg/dL [0.5–10],表明肾上腺皮质功能得到了适当的抑制。继续在当地兽医诊所接受肾上腺皮质功能亢进的持续管理。
术后3个月和3年的电话随访确认患者临床状况良好,未出现胃肠道症状复发或皮肤瘘管形成。
08 讨论
皮肤肠瘘(enterocutaneous fistula, ECF)指腹壁皮肤与肠腔之间形成异常慢性通道,临床以持续或间歇性渗液、感染、电解质-蛋白丢失及伤口愈合障碍为特征。
人医报道多见于克罗恩病、肿瘤、放疗或术后吻合口并发症,死亡率高,治疗棘手。小动物临床罕见,文献仅见于骨盆创伤、咬创、腹腔纱布遗留等个案,空肠造瘘管相关ECF尚缺报道。
本例患犬术后四月才出现瘘口,提示为“延迟型”ECF。作者认为,潜在肾上腺皮质机能亢进是决定性诱因:
- 糖皮质激素持续升高→真皮萎缩、成纤维细胞增殖受抑→造口处腹壁与肠壁连接组织脆弱;
- 免疫抑制→局部微感染或缝线刺激即可触发慢性炎症,终致上皮化通道形成。
术中所见亦支持“组织脆弱”假说:瘘管累及约1/2肠周径,但无脓肿、缺血或吻合口裂开,符合“渐进性组织崩解”而非急性技术失败。
本病例采用“锁箱式固定”,文献显示其抗脱管、抗渗漏能力优于传统荷包或Witzel法,且本例首次术后短期恢复顺利,可排除操作不当。瘘液培养出奇异变形杆菌、大肠埃希菌,为皮肤及肠道常驻菌,属二次定植;术中未见腹腔脓苔或纱布残留,故感染更可能是结果而非始动因素。此外,患犬首诊时伴发急性胰腺炎,但出院时胰酶已复常,无持续炎症证据;肾上腺皮质机能亢进则在ECF出现后才被确诊,提示长期高皮质醇血症持续削弱伤口。
人医资料显示,ECF若合并糖尿病、长期激素使用或恶性肿瘤,复发率高达20–30%。本例通过一次性完整切除+足量曲洛司坦,随访36个月无复发,提示早期识别并系统纠正内分泌紊乱,可逆转糖皮质激素对胶原合成的抑制;锁箱式固定法仍可作为高并发症风险动物的优选技术,但对肾上腺皮质机能亢进患犬需延长皮肤-管周护理时间(≥2周),并在拔管后1、3、6个月定期复查腹壁超声,以便及时发现亚临床积液或线道感染。
总之,本病例首次证实肾上腺皮质机能亢进相关空肠造瘘管可导致延迟性皮肤肠瘘。临床提示对高龄、皮肤变薄、伤口愈合缓慢的空肠造瘘管患犬,应筛查肾上腺皮质机能亢进;一旦确诊,需在拔管前后强化内分泌管理并延长随访期;对慢性、直径>1 cm且已上皮化的ECF,早期手术切除优于长期换药;围手术期联合培养-导向抗菌、合理镇痛及营养支持,是降低死亡率和复发率的关键。
文献来源:Moon JS, Choi HJ, Han HJ. Enterocutaneous fistula as a long-term complication of jejunostomy tube placement in a dog with hyperadrenocorticism. BMC Vet Res. 2025 Oct 6;21(1):586.