
| 品种:罗威纳犬 | |
| 年龄:8岁 | |
| 性别:雄 | |
| 诊断:非朗格罕细胞组织细胞增生症 | |
01 主诉及病史
因嗜睡、厌食、间歇性喘息就诊。
几个月前的胸部X光、血液学检查,包括电解质、葡萄糖和肾脏标志物,没有发现异常。
在当地医院胸部X光片显示间质或肺泡病变,怀疑由于之前流涎引起的吸入性肺炎。腹部超声显示小肠节段性增厚,脾脏结节没有变化,将狗放置在氧气室中,接受静脉输液治疗(氨苄西林/舒巴坦、恩诺沙星和未知剂量的马罗吡坦2天)无好转,于是转诊。
02 检查
严重呼吸急促,伴有轻度流涎,在前腹侧肺野有弥漫性刺耳的肺音,直肠检查发现轻度前列腺肥大。动脉血气结果显示pH值低(7.266 [7.35-7.45]),高碳酸血症(PCO2 57.3mmHg [24–39]),碱剩余(-2.2 [-4–4])、碳酸氢盐(25.2mEq/L [17-27])、乳酸(1.9 [0-2])正常,存在低氧血症(PO2 58.7mmHg [70-92],sO2 79.7% [95-100]),符合急性原发性呼吸性酸中毒。
全血细胞计数和血生化结果显示轻度白细胞增多(20.1×10^3/mL [4.5-15]),轻度贫血(红细胞压积37% [40-55],HGB 12.5g/dL [13-20]),轻度低镁血症(1.5mg/dL [1.8-2.4]),中度低白蛋白血症(2.2g/dL [3.0-4.3]),正常血清碳酸氢盐(25.3mEq/L [15-27])和轻度低氯血症(105.3mEq/L [108-118])。
胸部X光片显示整个肺部周围有许多边缘模糊、大小不一的斑片状区域,其中一些具有结节状外观(下图)。
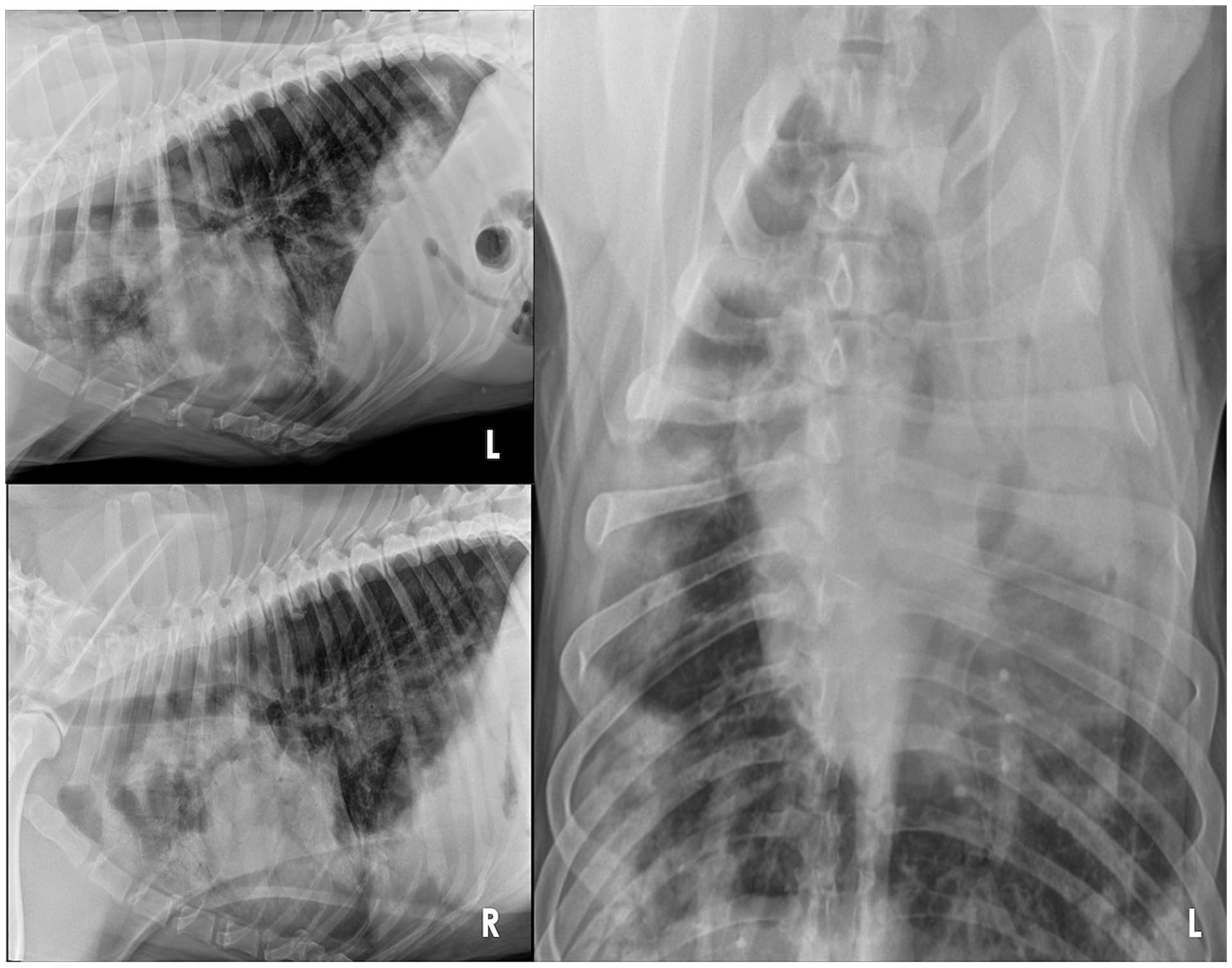
胸腹部CT显示了一个明显的多灶性软组织斑片状区域,伴有空气支气管造影,主要分布在整个肺部的腹侧,整个肺部周围有许多边界较差、大小不一的斑片状至结节状区域(下图)。胸骨、头纵隔、气管支气管和空肠淋巴结轻度肿大。在前腹侧肝脏和脾脏头部也发现了囊性结节,前列腺中度增大。
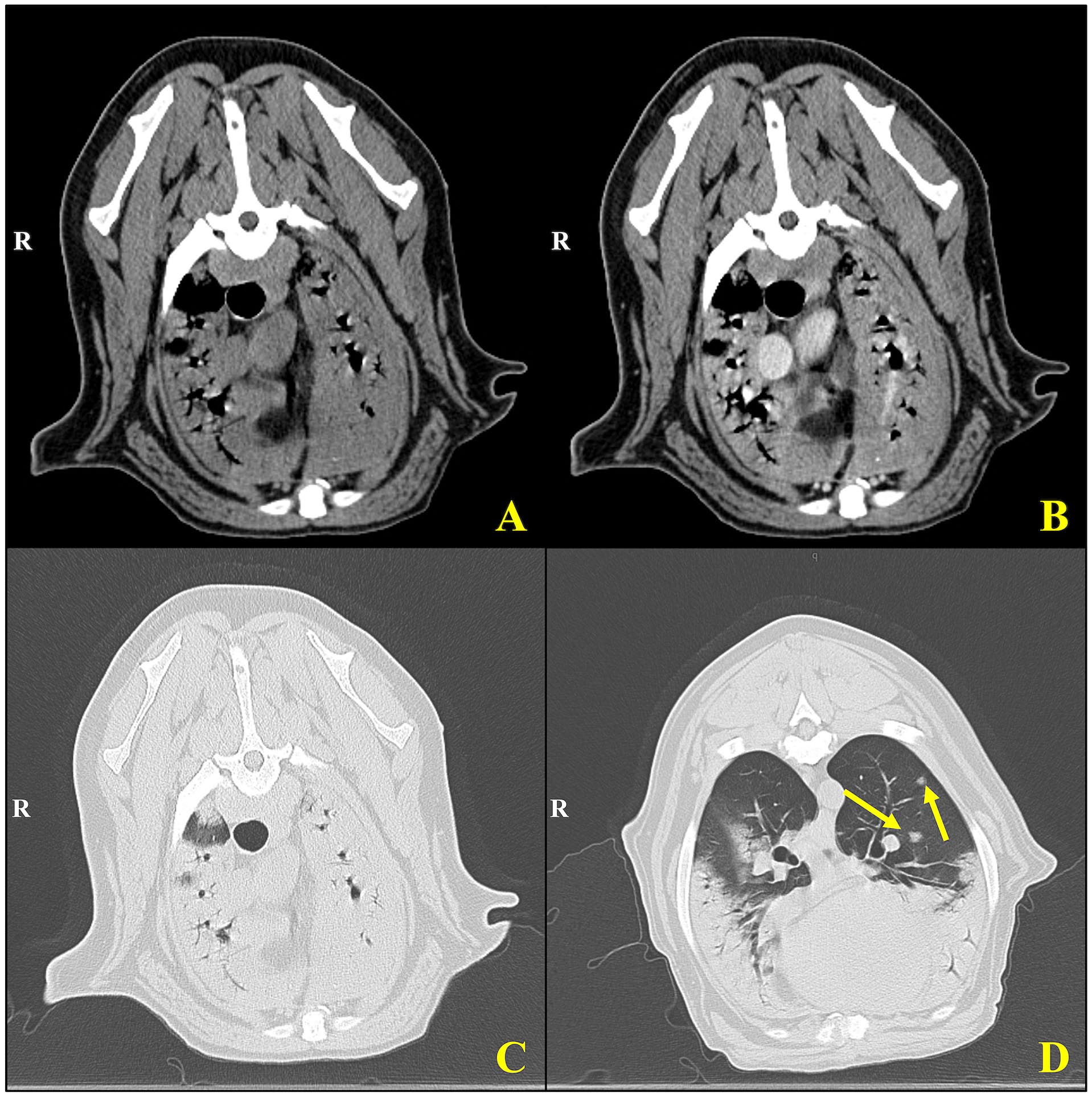
↑(A)对比前和(B)对比后图像显示纵隔和支气管周围结构,有可见的血管标志。对比后图像(B)显示纵隔血管和软组织的增强,有助于评估潜在的淋巴结肿大或血管异常。(CD)肺窗图像提供了实质结构的详细视图,(D)突出显示了前肺叶和中肺叶内多个轮廓分明的肺结节(黄色箭头)。这些结节呈随机分布,大小略有不同,符合肉芽肿性炎症或转移性疾病过程。
活化部分凝血活酶时间轻度升高(aPTT 14.9s [9.8-13.3]),抗凝血酶浓度轻度降低(AT 73% [104-162]),D-二聚体浓度(0.72 μg/mL [0.03-0.4])和纤维蛋白原(612 mg/dL [123-210])轻度升高,提示非特异性全身炎症。
肺部细针穿刺显示中度混合炎症(中性粒细胞和组织细胞),没有发现细胞外或细胞内细菌、上皮发育不良和非典型间充质增生。
03 治疗
鉴于预后的不确定性和侵袭性肿瘤的可能性,主人选择了安乐死和尸检。
04 预后
粗略评估,约95%的肺实质含有0.5-3厘米的淡褐色结节(下图)。当放入10%福尔马林中时,肺部没有漂浮。脾脏有大于10个深红色或浅棕色的硬结节,大小为0.5-3厘米。肝脏有多处疑似包膜纤维化的区域,这些区域没有延伸到下面的实质。前列腺不对称增大,右叶尾部呈深棕色,1cm结节。

↑(A)肺明显有严重变色,触诊坚硬,多灶性黄褐色结节外观。(BC)显示了不同阶段的解剖,重点是肺部病变的浸润性和纤维化性质。(D)在切面上对肺部进行特写,以突出胸膜上覆盖着纤维蛋白渗出物的聚结病变,胸膜占据了肺组织的很大一部分,切面上有一个结节,这是急性炎症反应的特征。
组织学上,肺泡弥漫性充满嗜酸性液体、细长的嗜酸性物质(纤维蛋白)、大量未退化的中性粒细胞和集中的泡沫状和色素性巨噬细胞。肺泡隔经常被巨噬细胞和未退化的中性粒细胞占据(下图)。肉芽肿中心区域有未退化的中性粒细胞和核碎裂碎片,由上皮样巨噬细胞排列,周围被纤维化包围,产生肿块样效应。大气道被淋巴细胞、浆细胞和中性粒细胞浸润,管腔内充满脱落的上皮和未退化的中性粒细胞。胸膜表面明显弥漫性扩张,有许多淋巴细胞、浆细胞、巨噬细胞和纤维蛋白。脾脏出现良性淋巴增生和出血,肝脏出现多发性慢性包膜纤维化,小肠出现中度慢性淋巴浆细胞性肠炎。

↑(A)H&E染色切片显示两条气道,支气管周围区域有明显的巨噬细胞浸润。(B)显示了支气管腔周围巨噬细胞的积聚。(CD)CD204的免疫组织化学染色突出了这些巨噬细胞在同一气道周围强阳性染色,证实了大量巨噬细胞的存在。(D)肉芽肿的中心区域有退化的中性粒细胞和核碎裂碎片,周围有上皮样巨噬细胞,周围有纤维化,在组织中产生肿块效应。
在肺组织上进行的特殊染色包括Giemsa、甲基胺银染、PAS、Ziehl-Neelsen抗酸染色、Luna、Gram、银染、Site抗酸染色和Warthin Starry染色,所有结果均为阴性。e-cadherin、CD3、PAX-5、S-100蛋白和犬瘟热病毒等标记物的免疫组织化学染色也均为阴性。CD204和IBA-1在上皮样巨噬细胞和肺泡组织细胞中显示出明显的细胞质内反应性。肺泡组织细胞对因子XIIIa、CD90和CD163表现出明显的细胞质内反应性,而上皮样巨噬细胞对这些标志物呈阴性。
其他测试包括肝组织的厌氧和有氧培养,均为阴性。肺组织样本进行犬瘟热病毒、兽疫链球菌、甲型流感病毒,巴尔通体、支原体、分枝杆菌PCR均为阴性。结合上述结果,最终诊断为非朗格罕细胞组织细胞增生症。
05 讨论
组织细胞增殖性疾病(Histiocytic proliferative disorder,HPD)在兽医学中有很好的记录。HPD来源于组织细胞的过度增殖,“组织细胞”指的是巨噬细胞或树突状细胞谱系的细胞[1-4]。
在狗中,HPD目前分为三大类:反应性组织细胞增生症、皮肤组织细胞瘤复合体和组织细胞肉瘤复合体[1,2]。它们的分类在很大程度上取决于疾病的临床行为及其组织病理学特征。虽然涉及朗格罕斯细胞的组织细胞性疾病在狗身上被很好地记录为组织细胞瘤和皮肤朗格罕斯细胞组织细胞增生症,但非朗格罕细胞组织细胞增生症(NLCH)尚未被报道。
与化脓性肉芽肿性支气管肺炎不同,后者通常以感染性病原体和中性粒细胞炎症为主[5],NLCH的特征是明显的组织细胞浸润,缺乏感染性病因,主要涉及巨噬细胞和树突状细胞。这种区分对于理解动物的这种新表现至关重要。
在人类中,NLCH的肺部表现很少见,更常见的诊断是成人的Erdheim-Chester病或Rosai-Dorfman病,儿童的青少年黄色肉芽肿[6]。目前,在人类中,HPD只能通过在肺活检组织或结外部位进行的免疫组织化学来区分[7,8]。
本病例也考虑了其他肺间质疾病,如嗜酸性肺炎、肺泡蛋白沉积症、弥漫性肺泡出血、脂质/类脂性肺炎、肺透明变性、肺泡微结石病和组织细胞肉瘤综合征。然而,这些情况都没有得到组织学证实。事实上,组织学更暗示了一种特殊的炎症或免疫介导的疾病。主要原因如下:
(1)以中小细支气管为中心的严重细胞浸润;
(2)主要由CD204、IBA-1、CD163、CD90、因子XIIIa阳性大反应性肺泡巨噬细胞组成的细支气管中心浸润;
(3)巨噬细胞替代粘膜;
(4)偶尔出现与非细支气管中心的结节类似的浸润;
(5)周围实质(包括血管周围和受影响的细支气管)中有大量淋巴浆细胞浸润,淋巴细胞和浆细胞浸润胸膜;
(6)在这种情况下,轻度至中度纤维化与人类中报告的NLCH更为一致[12,21,22]。
总之,NLCH是一种罕见的疾病,临床表现各异,给诊断带来了重大挑战。本报告描述了一例患有进行性呼吸衰竭的狗的肺部NLCH病例,其临床进展与人类的NLCH病例非常相似。根据临床病程、影像学和组织学结果,该病例与急性间质肉芽肿性肺炎最接近,同时也表现出肉芽肿性炎症和类似于Erdheim-Chester病的免疫表型特征。这表明肺部NLCH具有急性间质肉芽肿性肺炎重叠特征的新表现,将其与Erdheim-Chester病和经典急性间质肉芽肿性肺炎区分开来。
尽管在兽医学中很难进行明确的死前诊断,但关键指标——如呼吸体征的隐匿性发作、快速进展、成像上的外周肺结节、对抗菌和支气管扩张剂治疗的无反应性,以及特征性的细胞学和组织学发现——可能支持对肺部NLCH的考虑。进一步的研究对于完善其分类、探索其与其他间质和组织细胞疾病的关系以及改进诊断和管理策略至关重要。
文献来源:Granger KL Jr, Williams K, Ohlendorf A, Shropshire S, Hall KE. Case report: Pulmonary non-Langerhans cell histiocytosis in a dog with acute interstitial granulomatous pneumonia. Front Vet Sci. 2025 Feb 25;12:1522119.
参考文献
1.Moore PF. Histiocytic diseases. Vet Clin. (2023) 53:121–40.
2.Moore PF. Histiocytic proliferative diseases of dogs and cats. Schalm’s veterinary. Hematology 7th edition. (2022):633–48.
3.Argenta FF, de Britto FC, Pereira PR, Rissi DR, Gomes C, da Costa FVA, et al. Pulmonary Langerhans cell histiocytosis in cats and a literature review of feline histiocytic diseases. J Feline Med Surg. (2020) 22:305–12.
4.Fulmer AK, Mauldin GE. Canine histiocytic neoplasia: an overview. Can Vet J. (2007) 48:1041.
5.Leissinger M, Garber J, Fowlkes N, Grooters A, Royal A, Gaunt S. Mycobacterium fortuitum lipoid pneumonia in a dog. Vet Pathol. (2015) 52:356–9.
6.Emile J-F, Abla O, Fraitag S, Horne A, Haroche J, Donadieu J, et al. Revised classification of histiocytoses and neoplasms of the macrophage-dendritic cell lineages. Blood J Am Soc Hematol. (2016) 127:2672–81.
7.Classen C, Minkov M, Lehrnbecher T. The non-Langerhans cell histiocytoses (rare histiocytoses)–clinical aspects and therapeutic approaches. Klin Padiatr. (2016) 228:294–306.
8.Barros MS, Krupa BS, Madineni MD, Kenyon MD, Lawrence C, Farrell MD, et al. A rare case of a systemic non-Langerhans Histiocytosis presenting with diabetes insipidus and a tentorial mass. JHN J. (2015) 10:3.
9.Wang JN, Wang FD, Sun J, Liang ZY, Li J, Zhou DB, et al. Pulmonary manifestations of Erdheim–Chester disease: clinical characteristics, outcomes and comparison with Langerhans cell histiocytosis. Br J Haematol. (2021) 194:1024–33.
10.Braiteh F, Boxrud C, Esmaeli B, Kurzrock R. Successful treatment of Erdheim-Chester disease, a non–Langerhans-cell histiocytosis, with interferon-α. Blood. (2005) 106:2992–4.
11.Weitzman S, Jaffe R. Uncommon histiocytic disorders: the non-Langerhans cell histiocytoses. Pediatr Blood Cancer. (2005) 45:256–64.
12.Rush WL, Andriko JAW, Galateau-Salle F, Brambilla E, Brambilla C, Ziany-bey I, et al. Pulmonary pathology of Erdheim-Chester disease. Mod Pathol. (2000) 13:747–54.
13.Rissi DR, Brown CA, Gendron K, Good J, Lane S, Schmiedt CW. Pancreatic Langerhans cell histiocytosis in a cat. J Vet Diagn Invest. (2019) 31:859–63.
14.Busch M, Reilly C, Luff J, Moore PF. Feline pulmonary Langerhans cell histiocytosis with multiorgan involvement. Vet Pathol. (2008) 45:816–24.
15.Hernández-San Martín M, Vargas-Mora P, Aranibar L. Juvenile xanthogranuloma: an entity with a wide clinical spectrum. Actas Dermosifiliogr (Engl Ed). (2020) 111:725–33.
16.Kobayashi M, Tojo A. Langerhans cell histiocytosis in adults: advances in pathophysiology and treatment. Cancer Sci. (2018) 109:3707–13.
17.Tomokiyo R-i, Jinnouchi K, Honda M, Wada Y, Hanada N, Hiraoka T, et al. Production, characterization, and interspecies reactivities of monoclonal antibodies against human class a macrophage scavenger receptors. Atherosclerosis. (2002) 161:123–32.
18.Kato Y, Murakami M, Hoshino Y, Mori T, Maruo K, Hirata A, et al. The class a macrophage scavenger receptor CD204 is a useful immunohistochemical marker of canine histiocytic sarcoma. J Comp Pathol. (2013) 148:188–96.
19.Thongtharb A, Uchida K, Chambers JK, Kagawa Y, Nakayama H. Histological and immunohistochemical studies on primary intracranial canine histiocytic sarcomas. J Vet Med Sci. (2016) 78:593–9.
20.Hirabayashi M, Chambers JK, Sumi A, Harada K, Haritani M, Omachi T, et al. Immunophenotyping of nonneoplastic and neoplastic histiocytes in cats and characterization of a novel cell line derived from feline progressive histiocytosis. Vet Pathol. (2020) 57:758–73.
21.Reinero C. Interstitial lung diseases in dogs and cats part I: the idiopathic interstitial pneumonias. Vet J. (2019) 243:48–54.
22.Reinero C. Interstitial lung diseases in dogs and cats part II: known cause and other discrete forms. Vet J. (2019) 243:55–64.