
| 一般情况 | |
 | 品种:英国短毛猫 |
| 年龄:5岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:落叶型天疱疮 | |
01 主诉及病史
左耳廓出现非瘙痒性结痂性皮炎1个月。
曾使用甲强龙(0.4 mg/kg,q24h,1周)和一次头孢霉素皮下注射(8 mg/kg),病情缓解。但2周后,病变再次出现在两只耳廓上,并扩散到躯干和爪垫。
02 检查
体重5.5千克。皮肤检查发现耳廓(下图ab)和侧腹出现脱毛、棕色结痂和对称性红斑。爪垫上有鳞屑和结痂,主要位于边缘(下图c)。
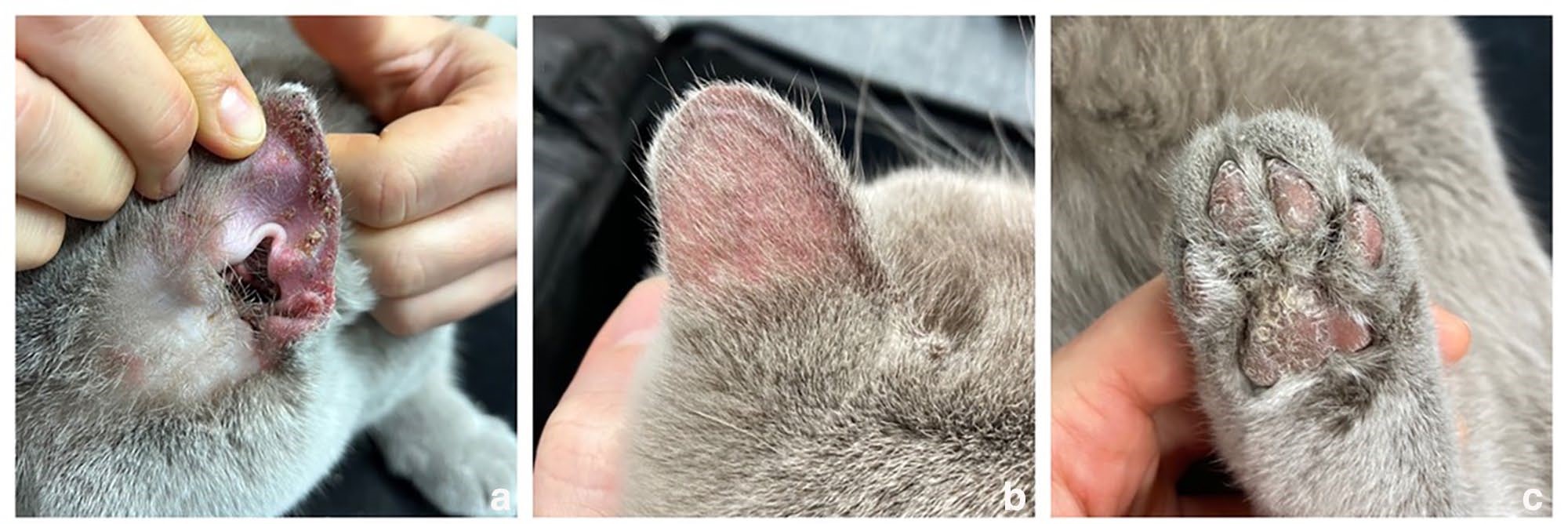
↑ (a)耳廓凹面有附着的棕色结痂;(b)耳朵背面顶端有弥漫性脱毛和灶性结痂;(c)脚掌和中央掌垫有严重脱屑和结痂。
对结痂下皮肤的印模涂片进行细胞学检查后发现,嗜中性粒细胞和棘细胞未变性,没有细菌。拔毛后发现毛尖和毛囊完好。
全麻后从侧腹和爪垫区域采集了四个4毫米的活检样本。组织病理学显示脓疱和结痂伴有中性粒细胞和棘层角质细胞,符合落叶型天疱疮。真菌阴性。
03 治疗
开始使用甲强龙(0.7 mg/kg,q12h)进行治疗。
04 预后
10天后,因呼吸困难和3天前出现的不合群、嗜睡和呼吸增快被送往急诊科。检查发现呼吸急促、腹部用力、肺部背侧呼吸音增强、腹部有喘鸣,心音减弱。全血细胞计数和血生化正常。
床旁超声显示双肺B线,表明肺间质或肺泡内液体增多,并有轻度胸腔积液。左心房增大,左心室增厚。考虑可能有慢性心衰,补充了氧气,并注射了呋塞米(每30分钟静脉注射3次,每次2 mg/kg,然后以0.7 mg/kg/h持续输注)。
病情稳定后的超声心动图显示肥厚型心肌病C期。由于血容量不足,无法对血样进行心肌肌钙蛋白I分析,血压正常。考虑甲亢或肢端肥大症的可能性较小,因为年龄较小,且没有临床症状。
2天后出院时服用呋塞米(2 mg/kg,q12h)和氯吡格雷(3.5 mg/kg,q24h)7天,直到下次复诊。由于怀疑甲强龙会引起一过性心肌增厚,因此改用地塞米松(0.09 mg/kg,隔天一次)。还开始使用霉酚酸酯(1克/5毫升口服混悬剂粉末,10 mg/kg,q12h)。
1周后,皮肤症状改善了10%。主人继续每天给猫注射一次地塞米松,肺水肿已缓解,心肌病也有所改善。在接下来的一个月里,呋塞米和氯吡格雷的用量逐渐减少,最终停用。
1个月后,皮肤症状改善了25%,耳廓上的毛发明显再生,没有结痂(下图de)。爪垫的改善速度最慢,但鳞屑明显减少(下图f)。在停止利尿剂治疗后,病情取得了积极进展。
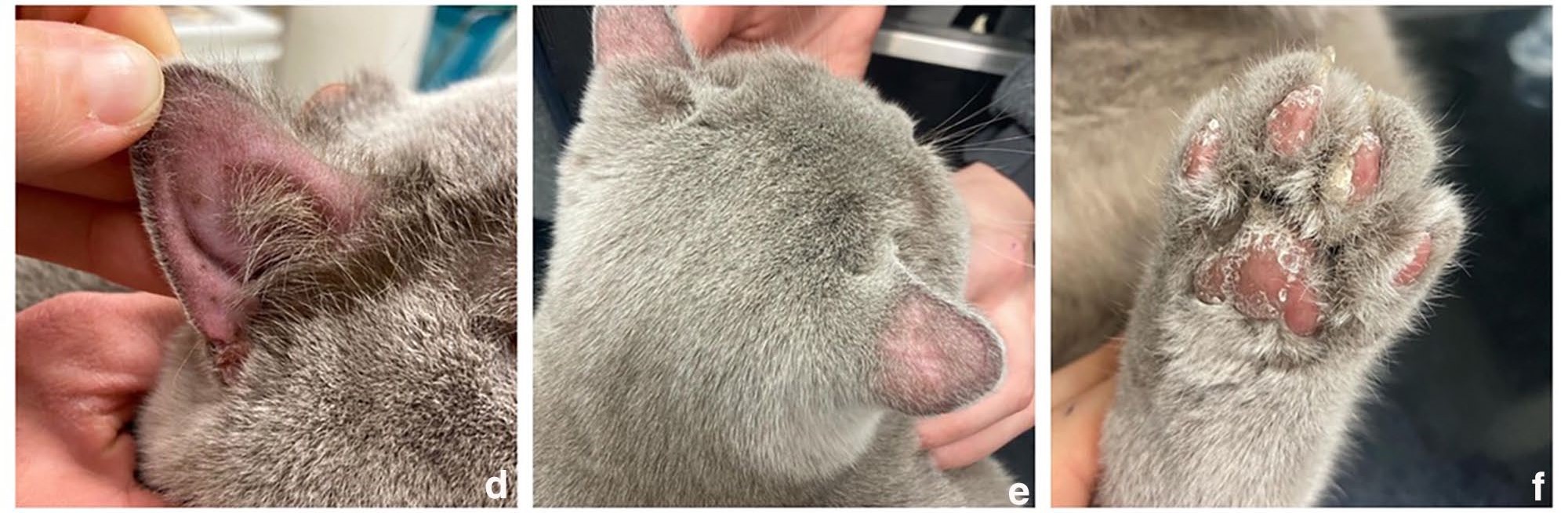
↑ (d)之前结痂区域的色素沉着现已消除;(e)耳廓背面的毛发开始重新生长,结痂已消失;(f)爪垫的脱屑和结痂得到部分改善,主要在中央区域。
4个月后,由于落叶型天疱疮已进入临床缓解期,地塞米松逐渐减量并停用(下图g-i)。此时心脏功能也恢复正常。

↑ (g)耳廓凹面和(h)背面以及(i)爪垫上的症状均已缓解。
尽管指南建议进行定期全血细胞计数和血压分析,但主人担心采血问题,最初没有进行检测。最终同意在霉酚酸酯治疗第15周时采血,结果显示中性粒细胞和血小板减少(下表)。怀疑骨髓抑制是由霉酚酸酯引起的,将霉酚酸酯的频率减少到每天一次,并每3周监测一次血液参数。
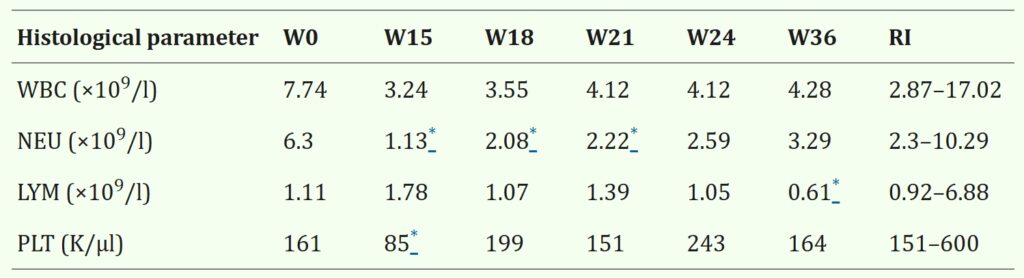
中性粒细胞减少在第一次复查(第18周)和第二次复查(第21周)期间有所改善,第三次复查(第24周)时已恢复正常。但耳廓上再次出现轻度脱屑,重新开始使用地塞米松(0.09 mg/kg,每周两次,连续3周,再改为0.05 mg/kg,每周两次,作为维持剂量)。在第四次复查(第36周)时,中性粒细胞计数继续改善,而轻度淋巴细胞减少被认为与使用皮质类固醇有关。
10个月后,没有出现病变,也没有报告与治疗有关的其他不良反应。
05 讨论
落叶型天疱疮(Pemphigus foliaceus,PF)是猫最常见的自身免疫性皮肤病。免疫球蛋白攻击角质细胞之间的细胞间连接,导致角质细胞内或角质层下的分离和棘层溶解。大多数病例的病因不明,但有些病例可能是由药物引起的[1,2]。
皮质类固醇是治疗猫PF的主要方法,大多作为单一疗法或与其他免疫抑制剂一起使用[1,2]。虽然猫一般被认为比其他物种更能抵抗皮质类固醇引起的副作用,但也有一些使用类固醇后出现充血性心衰的病例报道[3,4]。
霉酚酸酯(MMF)是肌苷-5′-单磷酸脱氢酶(IMPDH)的抑制剂,而IMPDH是嘌呤从头合成的关键酶。一旦转化为其活性代谢物霉酚酸(MPA),它就会阻止DNA复制所需的核苷酸的形成。这可减少活化的T淋巴细胞和B淋巴细胞的增殖,并减少自身抗体的产生[5,6]。
在兽医学中,MMF已被用作次级免疫抑制剂,但对猫的研究却很有限[5-10]。新近的文献报道了MMF在猫免疫介导疾病中的应用,与泼尼松龙联合使用可成功治疗难治性免疫介导溶血性贫血和免疫介导多关节炎[11,12]。
为了在保持疗效的同时进一步减轻皮质类固醇的副作用,本病例减少了剂量并添加了一种类固醇保护剂(MMF)。硫唑嘌呤因其对猫骨髓毒性的高风险而被排除,氯霉素因其骨髓抑制作用而被排除,环孢素因其需要较长的缓解时间而被排除[6,13]。
虽然以前没有关于猫PF的报道,但MMF被作为一种辅助免疫抑制剂开始使用。MMF被认为是治疗犬PF的低风险、节省类固醇的治疗选择[5,6],而MMF用于猫PF的药理学和安全性数据尚缺。
尽管健康猫缺乏葡萄糖醛酸转移酶活性,但事实证明它们能够快速消除MPA,不过MPA血浆水平的个体间差异可能会影响MMF治疗的安全性和有效性[7-10]。在猫体内,MMF的短期副作用通常较轻,且呈剂量依赖性和胃肠道性质[7,8],而长期使用则会带来感染、恶性肿瘤和潜在肝毒性或胰腺炎的风险[13,16]。
总之,本文报告了单独使用MMF以及辅助皮质类固醇治疗猫PF的成功案例。猫对MMF的耐受性良好,不良反应仅限于疑似药物引起的中性粒细胞减少和可能的血小板减少,这些症状轻微且可逆。在获得有关猫长期服用MMF的安全性和有效性的进一步数据之前,定期监测仍是至关重要的。此外,在开始使用皮质类固醇(尤其是醋酸甲泼尼龙)之前,兽医应谨慎对待猫患慢性心衰的潜在风险。
文献来源:Striuli G, Vandenabeele S, Gheeraert M, Smets P. Successful management of pemphigus foliaceus with mycophenolate mofetil as a steroid-sparing agent in a cat with corticosteroid-associated congestive heart failure. JFMS Open Rep. 2025 Apr 2;11(1):20551169251321376.
参考文献
1. Miller WH, Griffin CE, Campbell KL. Autoimmune and immune-mediated dermatoses. In: Miller WH, Griffin CE, Campbell KL. (eds). Small animal dermatology. 7th ed. St Louis, MO: Elsevier Mosby, 2013, pp 447–448.
2. Preziosi DE. Feline pemphigus foliaceus. Vet Clin North Am Small Anim Pract 2019; 49: 95–104.
3. Rush JE, Freeman LM, Fenollosa NK, et al. Population and survival characteristics of cats with hypertrophic cardiomyopathy: 260 cases (1990–1999). J Am Vet Med Assoc 2002; 220: 202–207.
4. Smith SA, Tobias AH, Fine DM, et al. Corticosteroid-associated congestive heart failure in 12 cats. Intern J Appl Res Vet Med 2004; 2: 159–170.
5. Tham HL, Davis JL. Pharmacology of drugs used in autoimmune dermatopathies in cats and dogs: a narrative review. Vet Dermatol 2024; 35: 453–476.
6. Viviano KR. Glucocorticoids, cyclosporine, azathioprine, chlorambucil, and mycophenolate in dogs and cats: clinical uses, pharmacology, and side effects. Vet Clin North Am Small Anim Pract 2022; 52: 797–817.
7. Slovak JE, Villarino NF. Safety of oral and intravenous mycophenolate mofetil in healthy cats. J Feline Med Surg 2018; 20: 184–188.
8. Slovak JE, Rivera-Velez SM, Hwang JK, et al. Pharmacokinetics and pharmacodynamics of mycophenolic acid in healthy cats after twice-daily venous infusion of mycophenolate mofetil for three days. Am J Vet Res 2018; 79: 1093–1099.
9. Slovak JE, Hwang JK, Rivera SM, et al. Pharmacokinetics of mycophenolic acid and its effect on CD4+ and CD8+ T cells after oral administration of mycophenolate mofetil to healthy cats. J Vet Intern Med 2019; 33: 2020–2028.
10. Slovak JE, Rivera SM, Hwang JK, et al. Pharmacokinetics of mycophenolic acid after intravenous administration of mycophenolate mofetil to healthy cats. J Vet Intern Med 2017; 31: 1827–1832.
11. Bacek LM, Macintire DK. Treatment of primary immune-mediated hemolytic anemia with mycophenolate mofetil in two cats. J Vet Emerg Crit Care (San Antonio) 2011; 21: 45–49.
12. Tamura Y, Nagamoto T, Segawa K, et al. Successful treatment and long-term follow up of idiopathic immune-mediated polyarthritis with mycophenolate mofetil in a cat. JFMS Open Rep 2020; 6.
13. Plumb DC. Plumb’s veterinary drug handbook. 9th ed. Stockholm, WI: PharmaVet, 2018.
14. Ployngam T, Tobias AH, Smith SA, et al. Hemodynamic effects of methylprednisolone acetate administration in cats. Am J Vet Res 2006; 67: 583–587.
15. Block CL, Oyama MA. Echocardiographic and biomarker evidence of plasma volume expansion after short-term steroids administered orally in cats. J Vet Intern Med 2020; 34: 29–36.
16. Kopke MA, Galloway PEK. Suspected hepatopathy and pancreatitis associated with mycophenolate mofetil use in a cat with immune-mediated haemolytic anaemia. JFMS Open Rep 2020; 6.