
| 一般情况 | |
 | 品种:迷你贵宾 |
| 年龄:19岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:认知功能障碍综合征 | |
01 主诉及病史
行为发生进行性变化,包括夜间不安、过度吠叫、夜间漫无目的地徘徊和强迫性踱步。
其他临床体征包括排尿不当和间歇性口腔出血。这些症状在3年内逐渐发展。
02 检查
体重5.2公斤。嗜睡,对环境刺激的反应较弱。粘膜苍白,右上颌可触及一个坚硬的肿块。轻度呼吸窘迫,呼吸频率为40次/分。左侧第四乳腺中发现疑似乳腺肿瘤。其他体格检查结果无明显异常。
评估了神经系统状况,表现出轻微的定向障碍,四肢的本体感觉略有下降。颅神经检查无明显异常,后肢体位反应轻度减弱。脊髓反射在正常范围内。
根据病史、体征、体格检查和神经系统检查结果怀疑为认知功能障碍综合征。在犬认知功能障碍评定量表上得分为64分,表明存在严重的认知障碍。
血液学评估显示严重贫血:血细胞比容13.5% [37.3-61.7],红细胞1.79×10^12/L [5.65-8.87],血红蛋白4.1 g/dL [13.1-20.5]。白细胞增多(30.75×10^9/L [5.05-16.76]),网织红细胞增多(333.6×10^3/μL [10-110])。
生化分析显示对二甲基精氨酸轻度升高(15 μg/dL [≤14])、丙氨酸氨基转移酶(57 U/L [0-50])和碱性磷酸酶(1036 U/L [23-212])以及C反应蛋白升高(50.8 mg/dL [0-10])。电解质正常。
头部CT显示右上颌骨有一个2.4×0.8×4.5 cm肿块,广泛的牙槽骨吸收影响上颌前磨牙和磨牙,内侧皮质骨完整。左乳腺区域的CT发现钙化肿块(1.9×2.9×3.0 cm),提示乳腺肿瘤。未观察到转移的证据。
MRI显示脑沟增宽和脑室扩大,符合脑萎缩。脑室与脑高度比为24-25% [<15%],表明脑室扩张。丘脑间粘附测量值为5.41毫米 [6.09-7.49],但比认知障碍中通常观察到的范围(3.03-4.61毫米)厚(下图)。
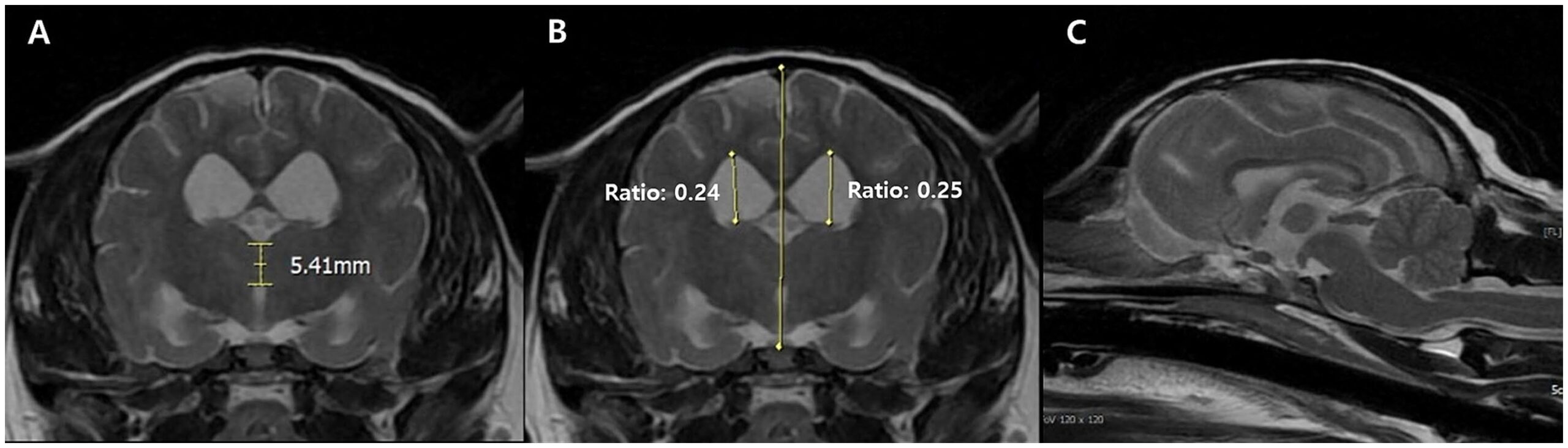
↑ 横向T2加权MRI图像。丘脑间黏附的测量值为5.41毫米,在横视图(AB)中,脑室与脑高度比的测量值为24-25%。可见脑沟增宽和脑室扩大(C)。
T2加权和弥散加权成像显示位于大脑背外侧区域的右侧顶叶和枕部多灶性高信号,符合缺血性病变。表观弥散系数映射证实弥散受限,表明脑梗塞(下图)。这些发现提示脑血管异常导致的认知功能障碍和神经功能缺损。
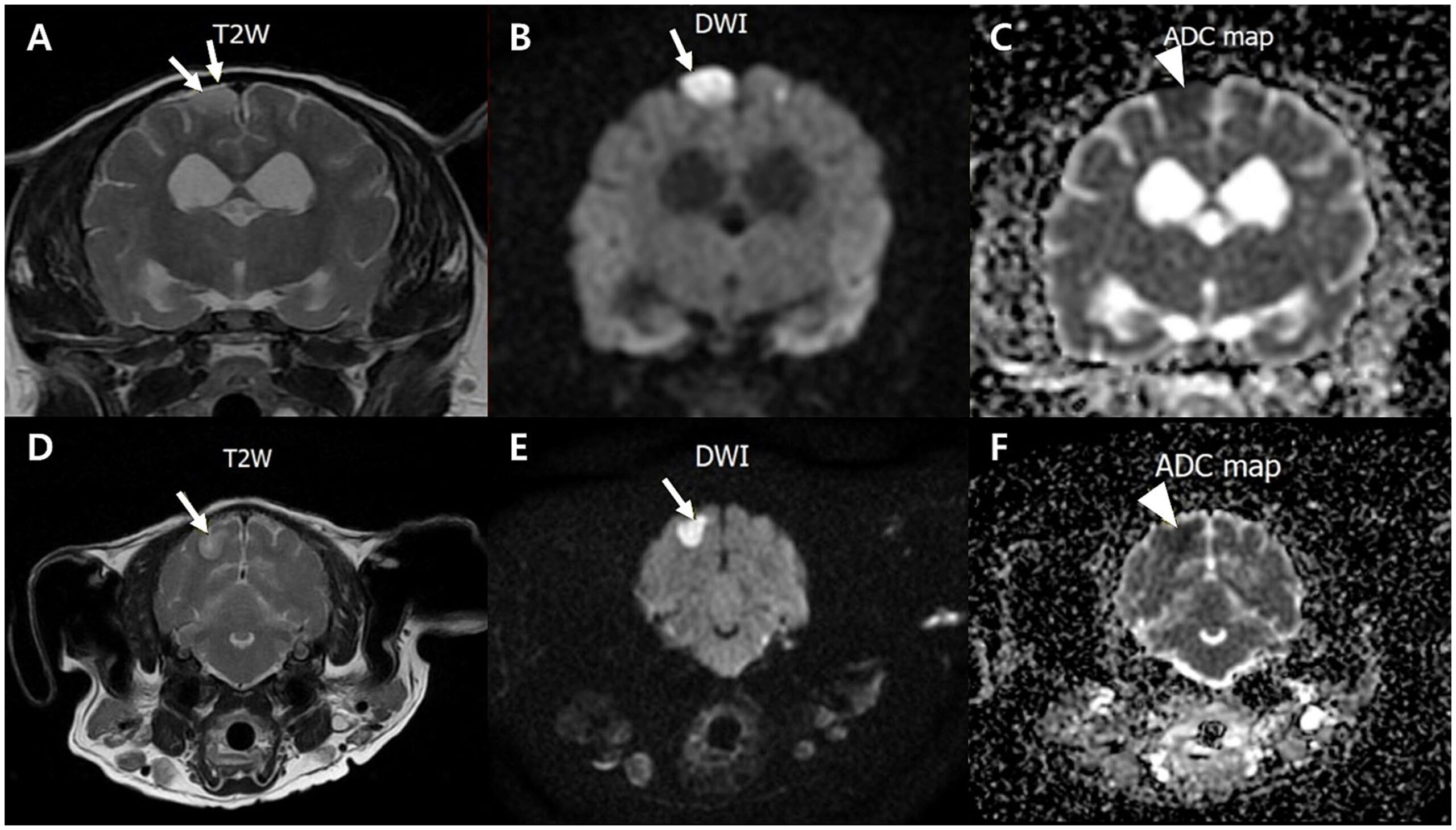
↑ 病变位于右侧顶叶(A-C)和枕部(D-F),表现为高信号,T2(AD)和弥散加权成像(BE)上为外周低信号(箭头),表观弥散系数图(CF)为低信号(箭头)。
03 治疗及预后
鉴于临床状况的严重性,主人选择了安乐死。进行了以中枢神经系统为重点的尸检,以确认影像学检查结果并全面了解潜在病理。
04 尸检
组织病理学分析显示广泛的神经变性,广泛的空泡化和神经元坏死突出影响中央内前区和胼胝体下前区(下图AB)。对应于MRI上观察到的高信号区域的右侧顶叶区域,显示血管内微血栓分布在血管周围和周围皮质区域,符合缺血性脑损伤(下图CD)。
许多小胶质细胞和星形胶质细胞与神经元密切相关,表明反应性神经胶质增生(下图E)。在海马体(下图F)和脑干(下图G-I)中观察到Pyknotic神经元和类似于神经原纤维缠结的结构。在脑干中鉴定出路易体样结构(下图J),表明蛋白质聚集异常的可能性。血管异常包括额下回(下图K)和胼胝体下区域(下图L)的出血性梗塞。
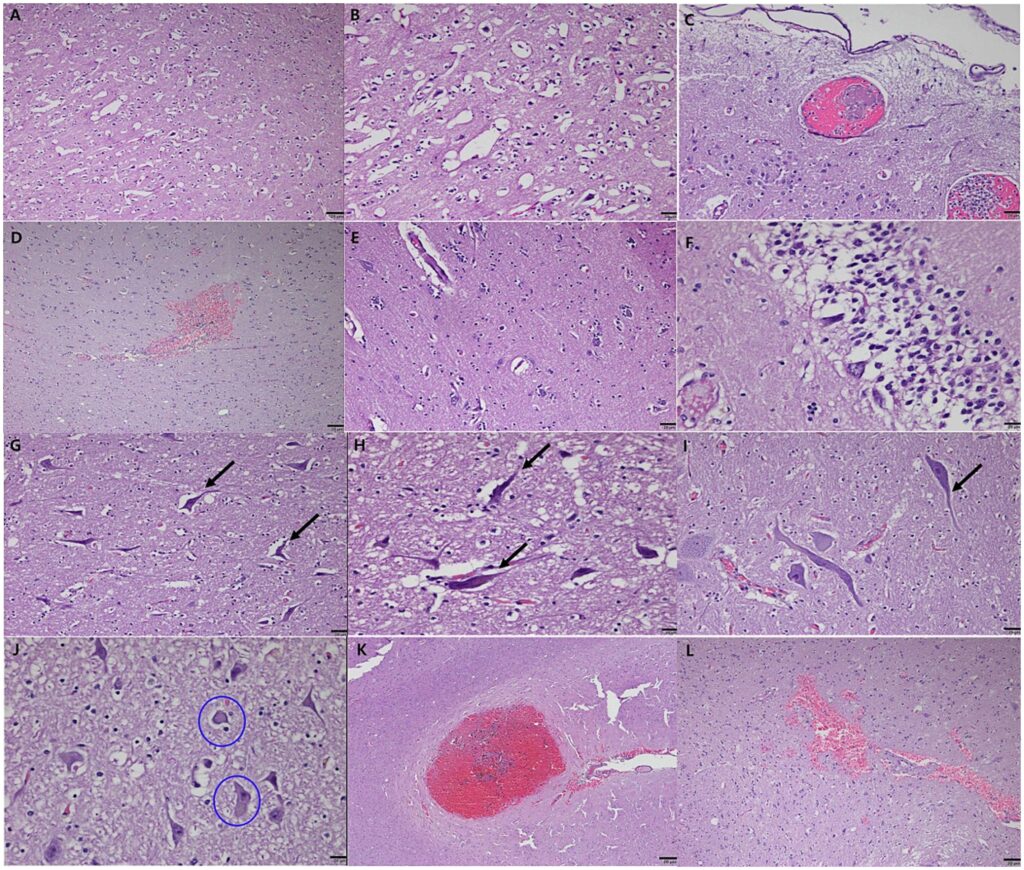
↑ 大脑皮层中央内前区和胼胝体下前区的严重空泡化和神经元坏死 (AB),显示广泛的空泡(A)及明显的神经元坏死(B)。血管内微血栓分布在血管周围(C)和右顶叶(D)。在周围皮质区域观察到反应性胶质增生,伴有许多与神经元密切相关的小胶质细胞和星形胶质细胞(E)。海马体1和2区域的Pyknotic神经元和神经原纤维缠结样结构,类似于人类神经退行性疾病的特征(F)。脑干(G)和小脑后叶(HI)中的轴突变性和神经原纤维缠结样结构。在脑干的神经元细胞中鉴定出路易体(圈出),表明蛋白质聚集异常(J)。额下回(K)和大脑前半球(L)胼胝体下区域的出血性梗死。
刚果红阳性染色证实额叶(下图AB)、前额叶(下图CD)和小脑皮层(下图EF)存在淀粉样血管沉积。在尾状核附近的额回中观察到反应性神经胶质增生,伴有星形胶质细胞和小胶质细胞增加(下图GH)。这些发现支持合并脑血管病变的晚期神经退行性疾病的诊断。
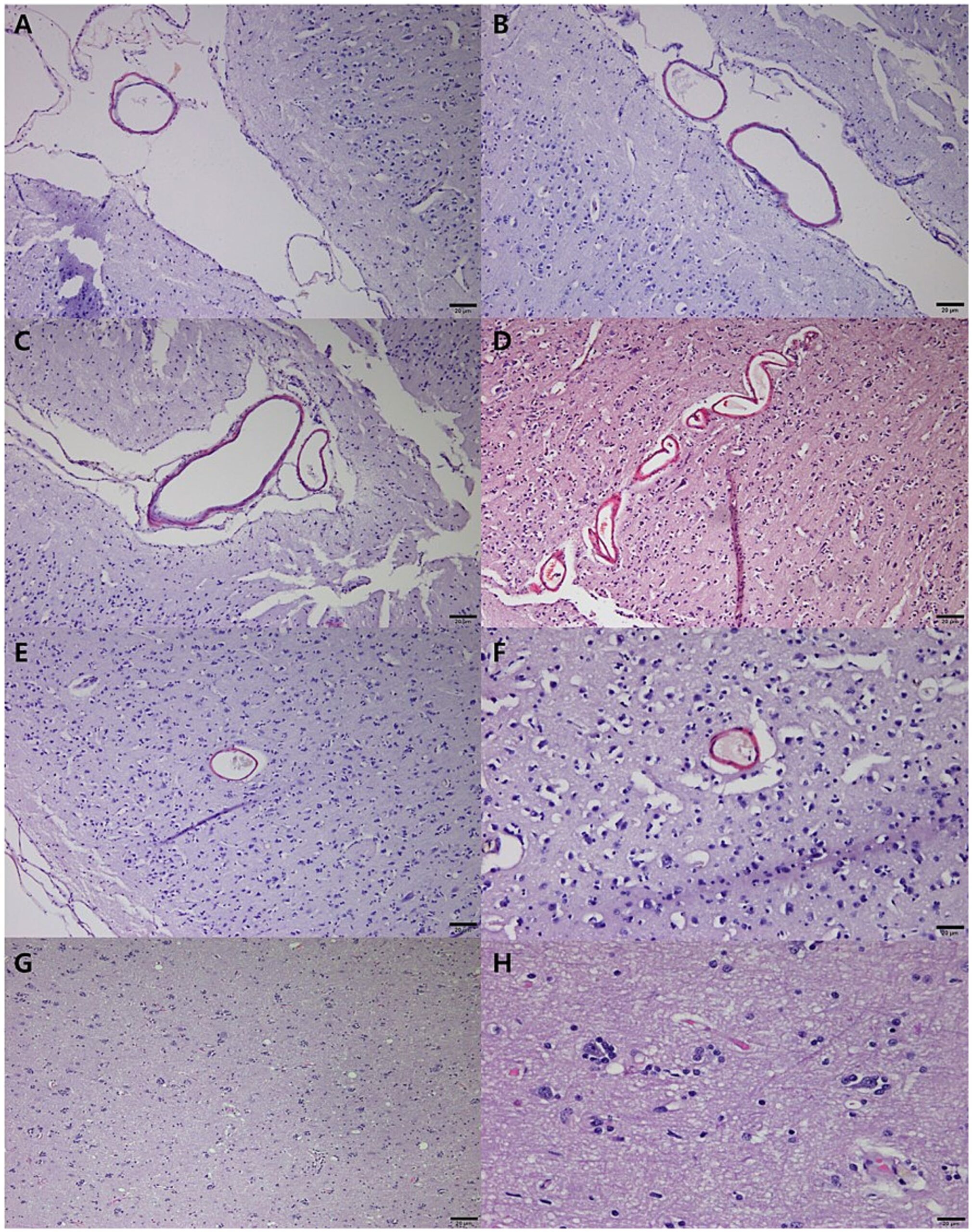
↑ 刚果红阳性维管沉积物位于额叶皮质表面褶皱较少的沟内的静脉中(AB)。淀粉样蛋白沉积在前额叶皮层的血管中,特别是在皮质表面的脑沟中(CD)。大脑前皮层(E)和后(F)边缘回血管呈阳性,神经元周围血管增厚。尾状核附近额回的反应性胶质增生,特征是星形胶质细胞和小胶质细胞(GH)增加。
05 讨论
犬认知功能障碍综合征(cognitive dysfunction syndrome,CDS)是一种在老年犬中观察到的神经退行性疾病,由于相似的临床体征和神经病理学特征,通常与人类的阿尔茨海默病(AD)类似[1,2]。
CDS主要影响8岁以上的狗,导致进行性认知能力下降、行为异常和记忆障碍,与人类AD非常相似[3]。这些相似性使CDS成为研究神经退行性疾病的有价值的转化模型,有助于更好地了解跨物种的疾病机制[2,4]。然而,CDS仍然诊断不足,导致许多病例未经治疗,并严重影响了狗及其护理人员的生活质量。
尽管存在这些相似之处,但存在显著的病理差异。虽然CDS和AD都涉及神经元变性和血管变化,但AD的标志性特征,例如神经原纤维缠结和平野小体,在CDS犬中不存在[1,2,5,6]。然而,研究表明,衰老犬脑中的tau过度磷酸化和淀粉样蛋白β积累可能导致认知障碍,这加强了进一步研究共同和独特病理机制的必要性[6,7]。
脑血管病变,包括脑梗塞,在狗中并不常见,很少与CDS一起被记录[8]。然而,最近的研究表明,神经炎症、氧化应激和血管功能障碍可能导致神经退行性疾病和脑血管疾病,这强调了评估它们潜在相互作用的重要性[7,9,10]。调查这些联系可能会提高我们对它们对老年动物影响的理解并指导临床管理。
该病例的研究结果为脑血管病变在CDS进展中的作用提供了证据。MRI结果显示脑萎缩的标志性指标,包括脑沟扩大和脑室扩大,与衰老和慢性疾病引起的神经组织损失一致[14,17-19]。
弥散加权成像识别了右侧顶叶和枕叶区域的多灶性缺血病变,强调了脑血管事件在疾病进展中的作用[8,20,21]。这些缺血性变化,加上出血性梗塞,产生了一种复杂的病理,加剧了狗的认知和神经功能缺陷[6]。
在患有脑梗塞的狗中也报告了类似的观察结果,表明血管改变在神经退行性疾病中的重要性[4,21]。特别是,缺血性和出血性病变的存在已被证明会加剧神经退行性过程,进一步损害狗和人类的认知功能[10,17]。
总之,本病例说明了CDS的多因素性质,神经退行性和血管因素都与狗的临床表现有关。认知能力下降、缺血性梗死和淀粉样蛋白沉积的共存表明,CDS可能代表了神经退行性变和脑血管病变之间的复杂相互作用。
文献来源:Kang MH, Jeong WP, Nam CS, Yoon JW, Choi DM, Lee GS, Kim YJ, Dan TJ, Park HM. Case Report: Ischemic brain infarction and cognitive dysfunction syndrome in an aged dog. Front Vet Sci. 2025 Mar 19;12:1563798.
参考文献
1.Landsberg GM, Nichol J, Araujo JA. Cognitive dysfunction syndrome: a disease of canine and feline brain aging. Vet Clin North Am Small Anim Pract. (2012) 42:749–68.
2.McKean NE, Handley RR, Snell RG. A review of the current mammalian models of Alzheimer’s disease and challenges that need to be overcome. Int J Mol Sci. (2021) 22:13168.
3.Neilson JC, Hart BL, Cliff KD, Ruehl WW. Prevalence of behavioralchanges associated with age-related cognitive impairment in dogs. J Am Vet Med Assoc. (2001) 218:1787–91.
4.Vikartovska Z, Farbakova J, Smolek T, Hanes J, Zilka N, Hornakova L, et al. Novel diagnostic tools for identifying cognitive impairment in dogs: behavior, biomarkers, and pathology. Front Vet Sci. (2021) 7:551895.
5.Davis PR, Head E. Prevention approaches in a preclinical canine model of Alzheimer’s disease: benefits and challenges. Front Pharmacol. (2014) 5:47.
6.Smolek T, Madari A, Farbakova J, Kandrac O, Jadhav S, Cente M, et al. Tau hyperphosphorylation in synaptosomes and neuroinflammation are associated with canine cognitive impairment. J Comp Neurol. (2016) 524:874–95.
7.Hines AD, McGrath S, Latham AS, Kusick B, Mulligan L, Richards ML, et al. Activated gliosis, accumulation of amyloid β, and hyperphosphorylation of tau in aging canines with and without cognitive decline. Front Aging Neurosci. (2023) 15:1128521.
8.Wessmann A, Chandler K, Garosi L. Ischaemic and hemorrhagic stroke in the dog. Vet J. (2009) 180:290–303.
9.Jellinger KA. Alzheimer disease and cerebrovascular pathology: an update. J Neural Transm. (2002) 109:813–36.
10.Elman-Shina K, Efrati S. Ischemia as a common trigger for Alzheimer’s disease. Front Aging Neurosci. (2022) 14:1012779.
11.Salvin HE, McGreevy PD, Sachdev PS, Valenzuela MJ. The caninecognitive dysfunction rating scale (CCDR): a data-driven and ecologically relevant assessment tool. Vet J. (2011) 188:331–6.
12.Prpar Mihevc S, Majdic G. Canine cognitive dysfunction and Alzheimer’s disease – two facets of the same disease? Front Neurosci. (2019) 13:604.
13.Dewey CW, Davies ES, Xie H, Wakshlag JJ. Canine cognitive dysfunction: pathophysiology, diagnosis, and treatment. Vet Clin North Am Small Anim Pract. (2019) 49:477–99.
14.Ozawa M, Chambers JK, Uchida K, Nakayama H. The relation between canine cognitive dysfunction and age-related brain lesions. J Vet Med Sci. (2016) 78:997–1006.
15.Schutt T, Helboe L, Pedersen LO, Waldemar G, Berendt M, Pedersen JT. Dogs with cognitive dysfunction as a spontaneous model for early Alzheimer’s disease: a translational study of neuropathological and inflammatory markers. J Alzheimers Dis. (2016) 52:433–49.
16.Borras D, Ferrer I, Pumarola M. Age-related changes in the brain of the dog. Vet Pathol. (1999) 36:202–11.
17.Burbaitė E, Gradeckienė A, Juodžentė D, Jankauskas M. MRI abnormalities in a severe cognitive impairment mimicking a forebrain lesion in a geriatric dog. Braz J Vet Med. (2022) 44:e001022.
18.Dewey CW, Rishniw M, Johnson PJ, Davies ES, Sackman JJ, O’Donnell M, et al. Interthalamic adhesion size in aging dogs with presumptive spontaneous brain microhemorrhages: a comparative retrospective MRI study of dogs with and without evidence of canine cognitive dysfunction. PeerJ. (2020) 8:e9012.
19.Hasegawa D, Yayoshi N, Fujita Y, Fujita M, Orima H. Measurement of interthalamic adhesion thickness as a criteria for brain atrophy in dogs with and without cognitive dysfunction (dementia). Vet Radiol Ultrasound. (2005) 46:452–7.
20.Pugliese M, Carrasco JL, Gomez-Anson B, Andrade C, Zamora A, Rodríguez MJ, et al. Magnetic resonance imaging of cerebral involutional changes in dogs as markers of aging: an innovative tool adapted from a human visual rating scale. Vet J. (2010) 186:166–71.
21.Rodrigues LL, Mesquita LP, Costa RC, Gomes RG, Biihrer DA, Maiorka PC. Multiple infarcts and hemorrhages in the central nervous system of a dog with cerebral amyloid angiopathy: a case report. BMC Vet Res. (2018) 14:370.