
| 一般情况 | |
 | 品种:英国短毛猫 |
| 年龄:1.5岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:猫胃肠道嗜酸性粒细胞硬化性纤维增生症 | |
01 主诉及病史
4-5个月前出现慢性厌食以及呕吐和食欲不振。
当地医院检查发现脱水,相对心动过缓(162次/分),腹部触诊疼痛。腹部超声显示少量腹腔积液。腹部X光片确定浆膜细节丢失、中度气腹以及似乎与胃肠道汇合的软组织和气体不透明肿块(下图A-C)。皮下注射乳酸林格氏液(50 mL)后,紧急转诊治疗。
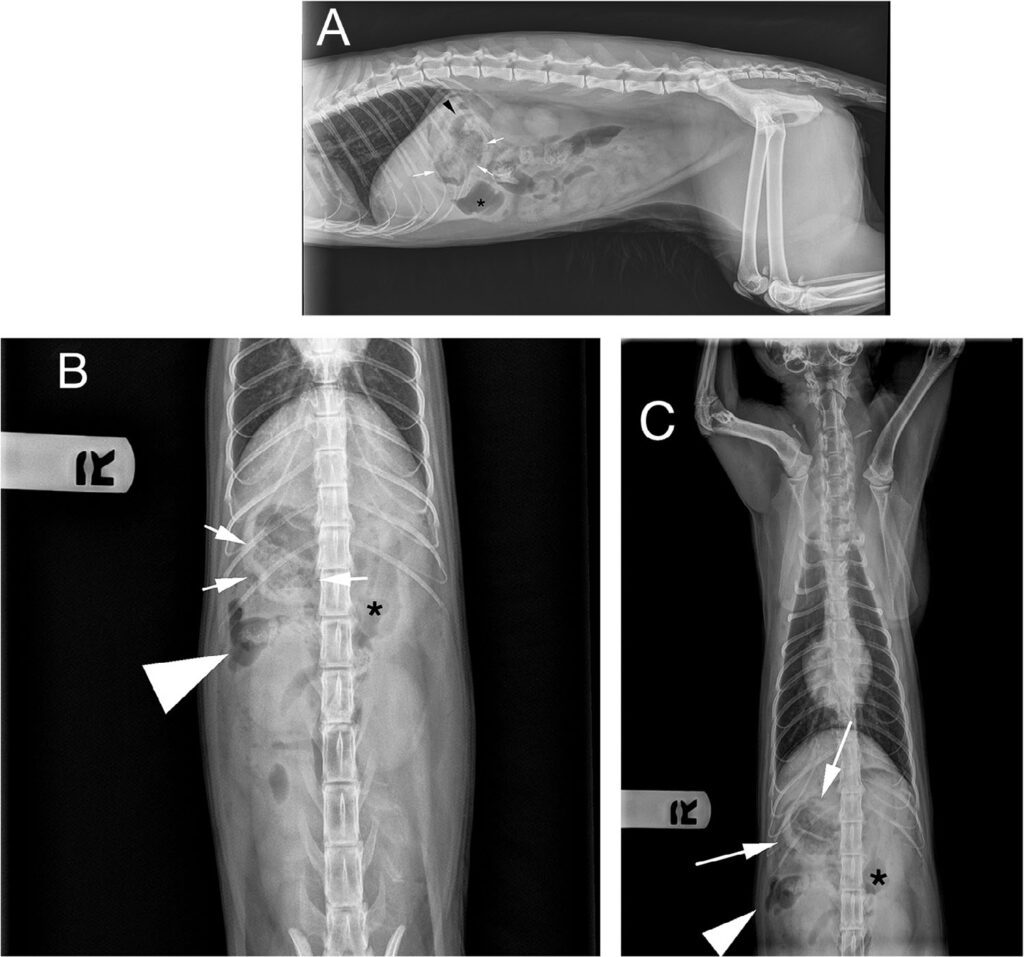
↑ 左侧腹部X光片(A)、腹背侧腹部X光片(B)和腹背侧胸部X光片(C)显示中度至明显气腹(白色三角)。在右前腹,存在孤立的、边界清晰的异质性软组织和气体不透明的肿块(白色箭头)。肿块与胃腔(黑色星形)和十二指肠降腔(黑色三角)汇合。
02 检查
精神迟钝,前腹触诊明显疼痛,心动过缓(152次/分)。脱水估计为5%,血压低至80-90 mmHg。静脉血气分析显示低碳酸血症(25.2 mmHg [33-52])、轻度高乳酸血症(2.7 mmol/L [0.6-2.5]),高血糖(8.0 mmol/L [4.2-6.6])和低离子钙血症(1.02 mmol/L [1.15-1.34])。
全血细胞计数和血生化异常包括淋巴细胞减少(0.7×10^9/L [0.83-9.1])、血液浓度(0.561 L/L [0.337-0.554]),ALT活性轻度增加(165 U/L [20-100])。无外周嗜酸性粒细胞增多,血清胆红素浓度正常。
腹腔积液通过床旁超声证实,但没有尝试采样。胸部超声未发现异常。高度怀疑胃肠道破裂,建议剖腹探查。
03 治疗
术前接受等渗晶体液和美沙酮(0.1 mg/kg,IV)。预先用芬太尼(5 μg/kg,IV)和阿法沙酮(1 mg/kg,IV)。用异氟醚(1.5%-2%在100%氧气中)、芬太尼(5-10 μg/kg/h,恒速输注)和单剂量氯胺酮(1 mg/kg,IV)维持麻醉。
常规进行剖腹探查术。发现存在中等量的絮状腹腔积液。幽门和十二指肠近端存在肿块,尺寸为5 cm3(下图)。肿块在十二指肠头附近的十二指肠肠膜面上破裂。腹部的其余部分没有明显变化。
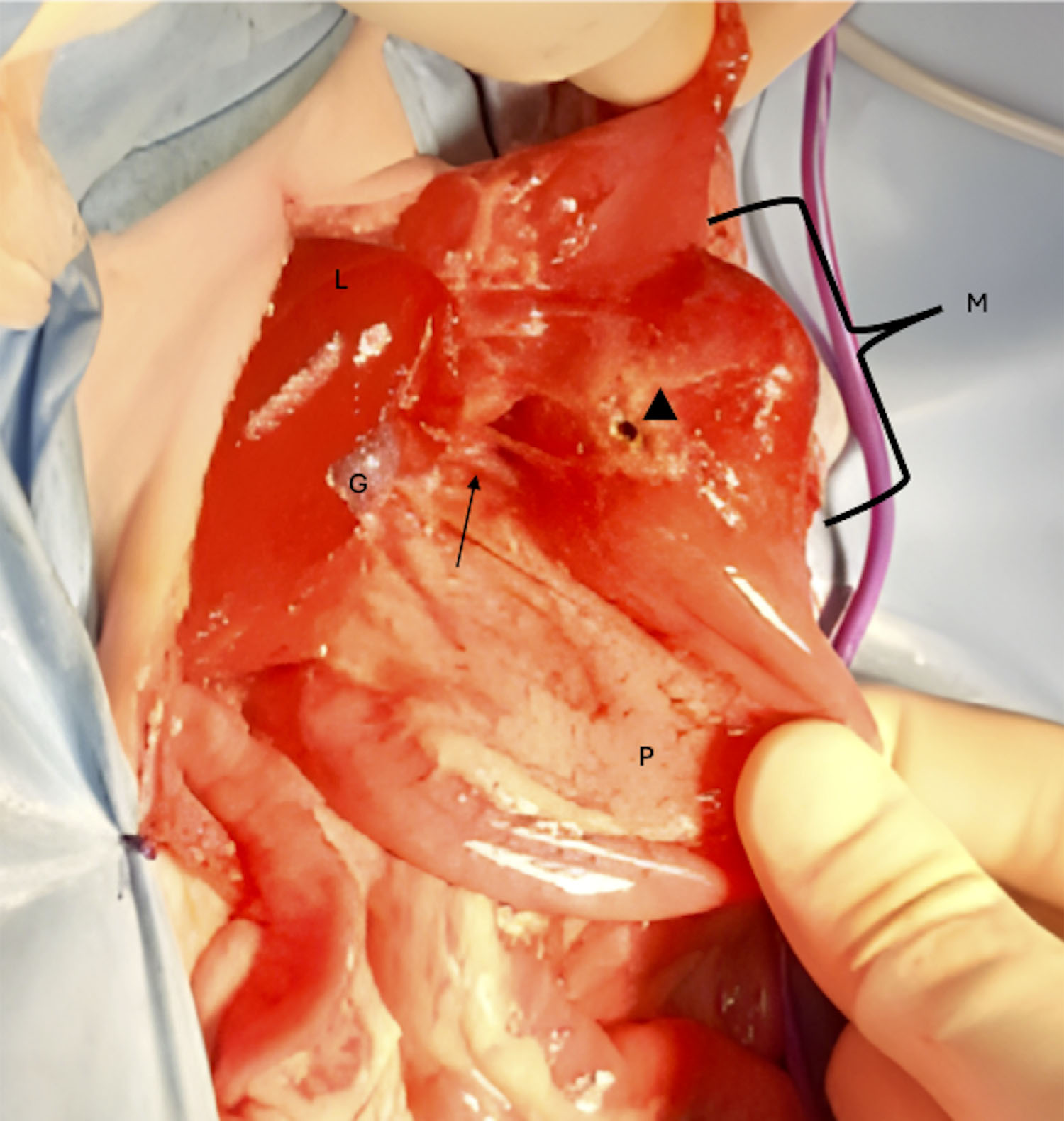
↑ 肿瘤病变(M)的术中照片。头位于图像的顶部。外科医生从头侧抓住胃底,从尾侧抓住十二指肠降部。胆总管(箭头)位于穿孔水平(三角)。P,左胰肢;G,胆囊;L,右内侧肝叶。
切除受影响的组织,切缘1 cm,包括幽门-肠切除术、部分胰腺切除术和胆总管结扎。以简单间断模式进行端到端的胃十二指肠吻合术。进行胆囊-肠造口术,吻合胆囊至远端十二指肠/近端空肠。
无菌生理盐水冲洗腹部,放置封闭式引流管,将一根5 Fr鼻胃管通过右鼻孔插入胃中,用于临时营养支持。腹部常规闭合。
术后住院4天。补充氯化钾(10 mEq/L)、维生素B1(2 mL/L)。镇痛药包括芬太尼(5 μg/kg/h,恒速输注)和氯胺酮(4 μg/kg/min,恒速输注)。其他疗法包括昂丹司琼(0.3 mg/kg,IV,q8h)、马罗吡坦(1 mg/kg,IV,q24h)、乙酰半胱氨酸(70 mg/kg,IV,q12h)和泮托拉唑(1 mg/kg,IV,q12h)。
在等待培养结果之前,使用的抗菌药物包括恩诺沙星(5 mg/kg,IV,q24h)、氨苄青霉素(22 mg/kg,IV,q6h)和甲硝唑(10 mg/kg,IV,q12h)。
最初以静息能量需求的25%进行流质饮食,在24小时内通过鼻胃管推注喂养,并根据耐受性升级到完全能量需求。由于胃残余量和恶心,加入西沙必利(0.5 mg/kg,PO,q8h)。一旦胃残余量改善,加入加巴喷丁(12 mg/kg,PO,q12h)和米氮平(2 mg,PO,q24h)。给予腺苷甲硫氨酸与水厘甘油醚和磷脂(100 mg,PO,q24h)用于抗氧化支持。
肿块的组织学分析显示透壁嗜酸性粒细胞性和富含肥大细胞的胃炎,伴有硬化性纤维增生和局部广泛性溃疡,这是猫胃肠道嗜酸性粒细胞硬化性纤维增生症(FGESF)的典型特征。肿块的切除在组织学上是完全的。
04 预后
住院过程中过渡到口服药物。镇痛降级为丁丙诺啡(15 μ/kg,经粘膜,q8h),术后第4天出院。由于出院时培养结果待定,因此开了7天疗程的阿莫西林克拉维酸(15 mg/kg,PO,q12h)、甲硝唑混悬液(10 mg/kg,PO,q12h)和普拉沙星(7.5 mg/kg,PO,q24h)。鼻胃管被拔除。手术时从腹腔培养出肠球菌,对所有抗菌剂敏感。
术后11天再次就诊,以评估反复呕吐和食欲不振。体重减轻(从3.97公斤减轻至3.51公斤),发热(40℃),腹部触诊疼痛。胸部和腹部超声未发现异常。主人拒绝进一步诊断性检查和住院治疗。
术后2周,胃口好,没有呕吐。体温正常(38.5℃),轻度进行性体重减轻(3.48 kg)。体格检查无异常。轻度中性粒细胞减少(2.28×10^9/L [2.5-8.5])、蛋白尿(1+)和胆红素尿(1+),尿比重1.064。肝酶和胆红素正常。胰脂肪酶轻度升高(6.4 μg/L [0-4.4]),钴胺素、叶酸和免疫反应性胰蛋白酶正常。开始使用泼尼松龙(5 mg,PO,q24h),丁丙诺啡在4天的过程中逐渐减少。
术后1个月,体格检查和体重保持不变。在家中呕吐,与喂食粗磨食物有关,与罐头食品无关。主人在1周后停用了泼尼松龙。为了减轻主人对使用类固醇的担忧,泼尼松龙减量恢复(2.5 mg,PO,q24h)。鉴于在家中间歇性呕吐,马罗吡坦按需使用。
术后7个月,在家里表现正常,但表现出周期性的呕吐和食欲不振。开了胰脂肪酶补充剂和维生素B12注射剂,呕吐频率有所改善。此后患者失访。
05 讨论
猫胃肠道嗜酸性粒细胞硬化性纤维增生症(FGESF)是一种越来越被描述和认可的猫胃肠道炎症性疾病。已报道了多种临床体征。然而,尚未报道自发性气腹和继发性脓毒性腹膜炎[1-5]。
许多患者已经描述了手术治疗,然而,最近的文献表明,与单独使用糖皮质激素治疗相比,接受手术干预的猫没有明显的生存获益[1-5]。FGESF的预后尚不完全清楚,最近的文献支持适当的治疗可获得良好的长期结局[5]。
最近的文献表明,年轻猫(中位年龄5.4岁)、布偶猫和公猫可能占比过高[1,5]。临床体征通常为慢性,包括食欲不振、呕吐、体重减轻、腹泻和可触及的腹部肿块[1,4,6,11,12]。FGESF可能被误诊为肿瘤,病变通常位于幽门和近端肠道,但也有报道遍及胃肠道和肠系膜[1-6,11-13]。也有报道称区域淋巴结、胰腺和肝脏的嗜酸性粒细胞性炎症[1,2,5,11,12]。
FGESF的典型组织病理学发现包括主要为嗜酸性粒细胞浸润和致密胶原的分支小梁,通常由梭形细胞群隔开。虽然炎性浸润主要为嗜酸性粒细胞,但细胞群可能多种多样[1,2,4]。肉芽组织通常存在于外围,这在取样时赋予了特有的坚硬或“砂砾”质地。病灶内细菌或真菌偶尔存在,但在本病例中未发现[1,2,4,6]。
FGESF的病理生理学仍不确定,然而,对胃肠道抗原的超敏反应伴嗜酸性粒细胞性炎症反应似乎很可能[1,2,4,5]。也有人提出遗传性嗜酸性粒细胞失调伴不适当的炎症反应,类似于嗜酸性肉芽肿复合体的发病机制[1,2]。传染性病原体在FGESF发展中的作用尚不清楚,但至少怀疑它会使炎症持续存在[2,4,6]。
已描述仅通过药物治疗即可治疗FGESF的良好结局,即使存在离散的肿块[3-5]。由于本例中破裂肿块的位置需要复杂的手术切除,因此药物治疗更适合于累及幽门或十二指肠近端的未穿孔FGESF病变。
尽管药物治疗通常会产生积极的结果,但FGESF猫的术中和围手术期死亡率似乎更高[1,4,11,12]。这可能反映了回顾性研究的偏倚,在这些研究中,在没有既往诊断的情况下,由于怀疑肿瘤形成,或者当切除会很复杂时,可能在术中给予安乐死[1,2,4,11]。当然,在这种情况下,进一步的诊断检查将更好地了解肿块的位置和性质、细胞学诊断,并有助于主人为Billroth手术做好准备。
本报告说明了感染性腹膜炎的新原因——FGESF病变穿孔。应考虑将FGESF作为猫胃肠道肿块的鉴别诊断,包括有穿孔、气腹和感染性腹膜炎的猫。该病例还记录了改良Billroth II(胃十二指肠而非胃空肠吻合术以及胆囊肠吻合术)的应用,该手术产生了良好的短期结果。虽然Billroth重建通常与肿瘤形成和不良预后有关,但如果存在其他病理,这些手术的结果可能仍然是较好的。
文献来源:Patterson EL, Ball EJ, Lavallee JM. Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia and Duodenal Perforation in a 1-Year-Old British Shorthair Cat. J Vet Emerg Crit Care (San Antonio). 2025 Apr 29:e13465.
参考文献
1. M. Linton, J. S. Nimmo, J. M. Norris, et al., “Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia: 13 Cases and Review of an Emerging Clinical Entity,” Journal of Feline Medicine and Surgery 17, no. 5 (2015): 392–404.
2. L. E. Craig, E. E. Hardam, D. M. Hertzke, et al., “Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia,”Veterinary Pathology 46, no. 1 (2009): 63–70.
3. B. Agulla, D. Diaz-Reganon, M. Garcia-Sancho, et al., “Remission of Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia in a Cat Treated with Corticotherapy,” Pakistan Veterinary Journal 41, no. 2 (2021): 309–312.
4. A. Weissman, D. Penninck, C. Webster, et al., “Ultrasonographic and Clinicopathological Features of Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia in Four Cats,” Journal of Feline Medicine and Surgery 15, no. 2 (2013): 148–154.
5. P. Černa, C. Lopez-Jimenez, K. Fukushima, et al., “Clinicopathological Findings, Treatment, and Outcome in 60 Cats with Gastrointestinal Eosinophilic Sclerosing Fibroplasia,” Journal of Veterinary InternalMedicine38, no. 2 (2024): 1005–1012.
6. M. Martineau, C. Tilmant, V. Risco Castillo, et al., “A Case of Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia Associated with Fungal Colonisation: Endoscopic Features, Treatment and Follow-Up,” Journal of Feline Medicine and Surgery 9, no. 1 (2023).
7. J. A. Smelstoys, G. J. Davis, A. E. Learn, et al., “Outcome of and Prognostic Indicators for Dogs and Cats with Pneumoperitoneum and No History of Penetrating Trauma: 54 Cases (1988–2002),” Journal ofthe American Veterinary Medical Association 225, no. 2 (2004): 251–255.
8. M. P. L. Cariou, Z. J. Halfacree, K. C. L. Lee, and S. J. Baines, “Successful Surgical Management of Spontaneous Gastric Perforations in Three Cats,” Journal of Feline Medicine and Surgery 12, no. 1 (2010): 36–41.
9. M. F. Costello, K. J. Drobatz, L. R. Aronson, and L.G. King, “Underlying Cause, Pathophysiologic Abnormalities, and Response to Treatment in Cats with Septic Peritonitis: 51 Cases (1990–2001),” Journal of the American Veterinary Medical Association 225, no. 6 (2004): 897–902.
10. L. E. Hinton, M. A. Mcloughlin, S. E. Johnson, and S. E. Weisbrode, Spontaneous Gastroduodenal Perforation in 16 Dogs and Seven Cats (1982-1999),” Journal of the American Animal Hospital Association 38, no. 2 (2002): 176–187.
11. G. A. Davidson, S. S. Taylor, M. J. Dobromylskyj, et al., “A Case of an Intramural, Cavitated Feline Gastrointestinal Eosinophilic Sclerosing Fibroplasia of the Cranial Abdomen in a Domestic Longhair Cat,” Journal of Feline Medicine and Surgery 7, no. 1 (2021).
12. M. E. Thieme, A. M. Olsen, A. D. Woolcock, et al., “Diagnosis and Management of a Case of Retroperitoneal Eosinophilic Sclerosing Fibroplasia in a Cat,” Journal of Feline Medicine and Surgery 5, no. 2 (2019): 1–7.