
| 一般情况 | |
 | 品种:德国牧羊犬 |
| 年龄:8岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:曲霉菌病 | |
01 主诉及病史
因2周来逐渐加重的后肢步态异常,伴随左前肢跛行和严重颈部疼痛就诊。
02 检查
头部低垂、双后肢本体感觉性共济失调,左前肢轻度行走性截瘫和II级跛行。双后肢及左前肢的本体感觉定位能力减弱。左前肢的撤回反射显著减弱。颈部活动伴随严重疼痛。怀疑左侧C6-T2椎管内脊髓病变,并伴有左前肢疑似神经根症状。
血液检查仅显示系统性炎症的非特异性指标(C反应蛋白4.44 mg/dL [0–0.8])。胸部X光片正常,而颈胸段和胸段脊柱X光片显示C6–C7、C7–T1、T5–T9、T10–T11和T12–T13水平的多个椎间盘狭窄,伴有不规则终板轮廓和亚软骨骨质硬化,怀疑多发性炎症或感染性椎间盘脊柱病。
对颈椎和颈胸椎脊髓进行了MRI检查,证实了多节段椎间盘病变的怀疑,表现为严重的、多发性的信号强度异常,伴有终板侵蚀,椎间盘(从C5到T1)的T2加权像上出现多发性高信号强度区域,T2加权像高信号强度提示左侧胸椎C6–C7节段的压迫性脊髓病变,T1加权成像的等信号强度且增强的占位性病变,伴左侧C7神经根受压,提示脊髓硬膜外脓肿(下图)。
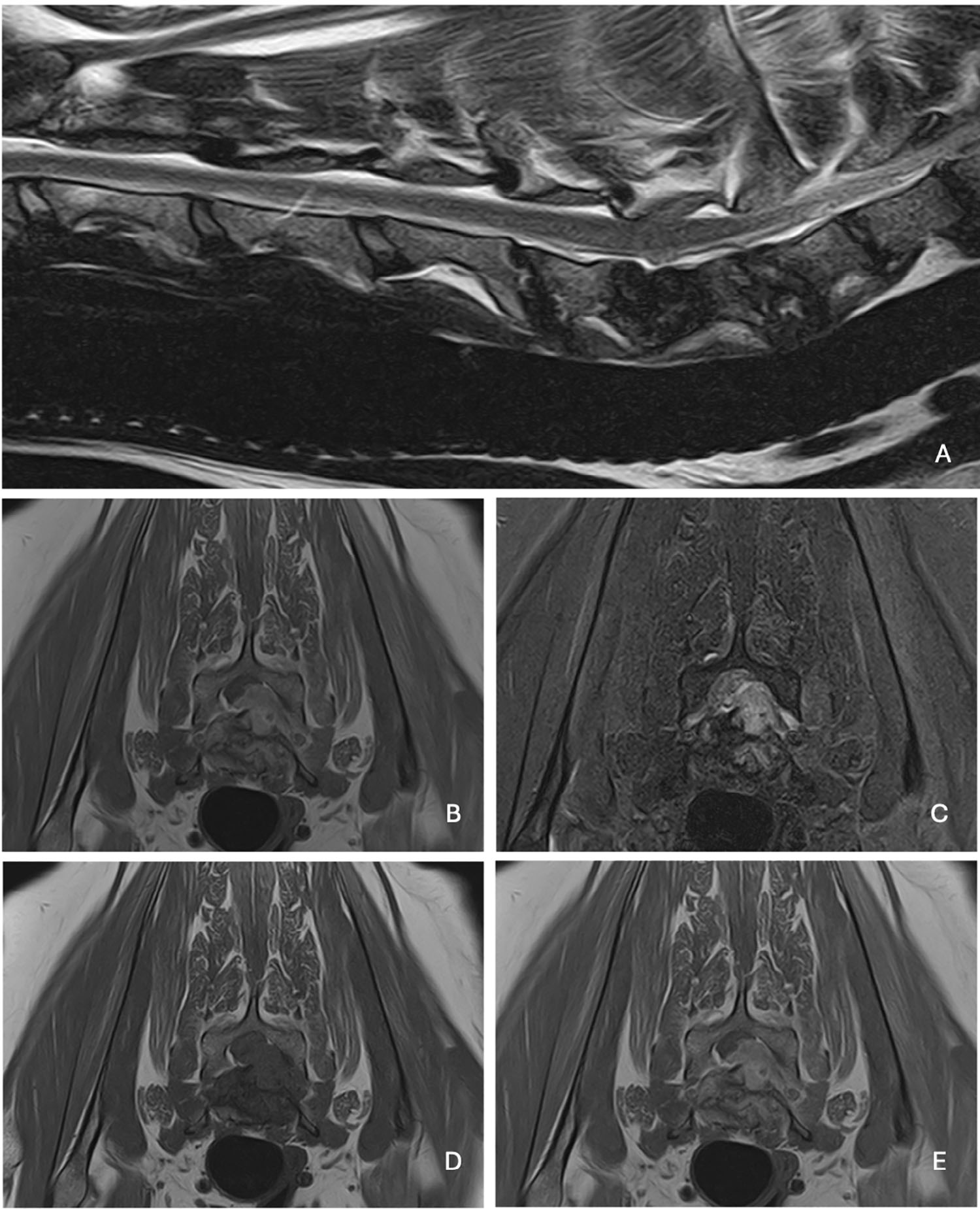
↑ (A)矢状位T2加权;(B)冠状位T2加权;(C)冠状位STIR;(D)冠状位T1加权;(E)冠状位T1加权增强。C5–T1水平椎间盘及相邻终板出现严重弥漫性信号强度改变,C6–C7水平存在T2高信号压迫性硬膜外物质,符合脊髓硬膜外脓肿的特征。
椎间盘组织的活检检查被主人拒绝,由于真菌性椎间盘炎被列入鉴别诊断清单,因此收集尿液以检测真菌菌丝,因为尿沉渣检查已被证明在系统性真菌疾病病例中具有高度指示性和微创性。
快速显微镜检查显示,MGG染色的尿沉渣中存在短菌丝(下图A)。首次培养物宏观观察显示存在生长缓慢、表面粗糙的菌落(下图B),即使在传代培养时亦然(下图C)。显微镜观察发现菌丝中含有大量末端和间隔的厚壁孢子,但未观察到分生孢子(下图D)。
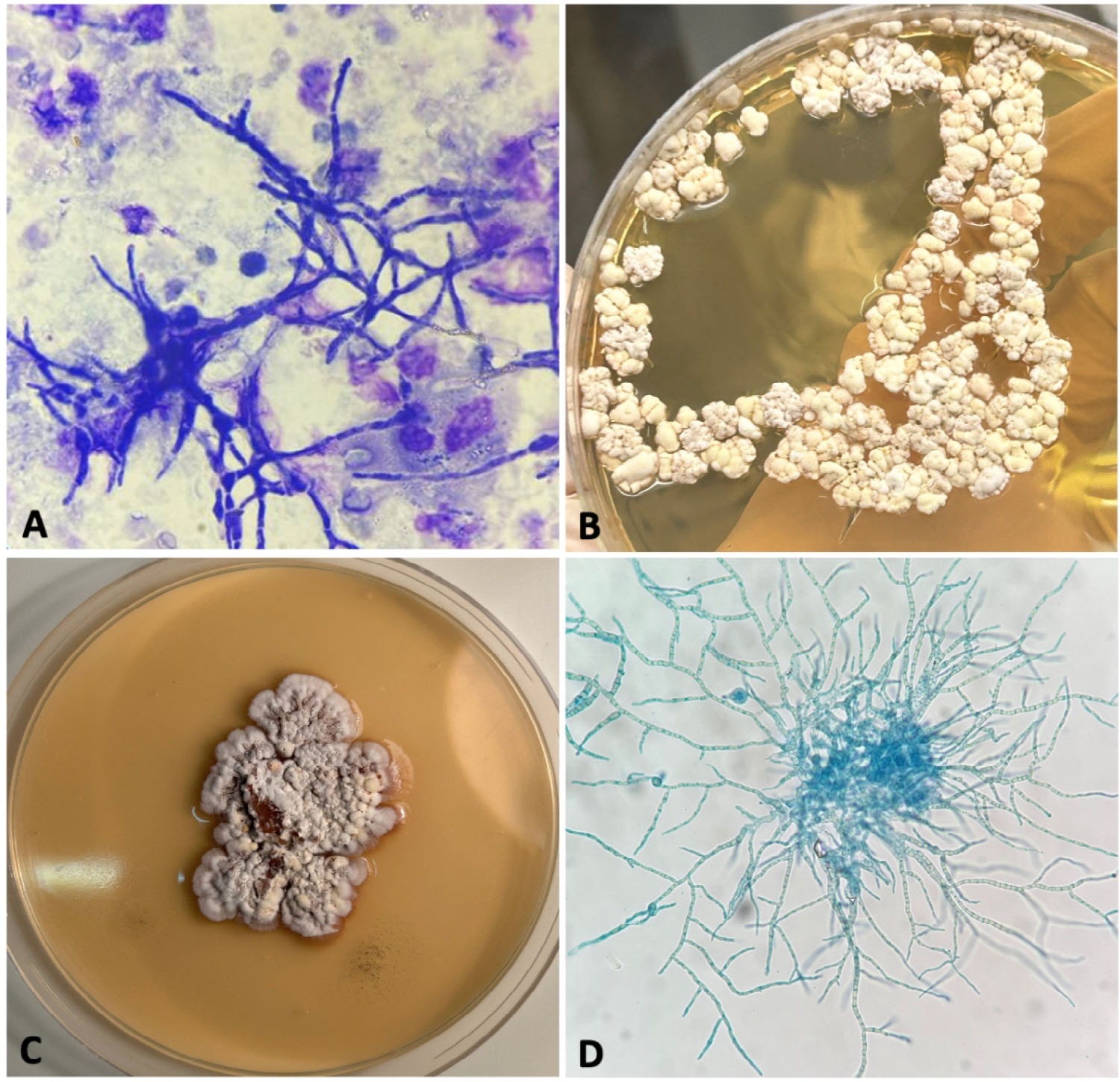
↑ (A)尿沉渣的MGG染色显示大量菌丝;(B)尿沉渣中分离出的菌落,在26°C下培养15天后于SAB-CAF培养基上生长;(C)菌落经CZAPEK琼脂培养20天后在26°C条件下培养的宏观形态;(D)乳酸酚蓝染色显示仅有菌丝和厚壁孢子,无典型分生孢子。
菌落经DNA检测及BLAST工具比对后,确认该菌株属于曲霉,与土曲霉(Aspergillus terreus)的序列一致性为100%,与丛毛状曲霉(Aspergillus floccosus)的序列一致性为99.84%。
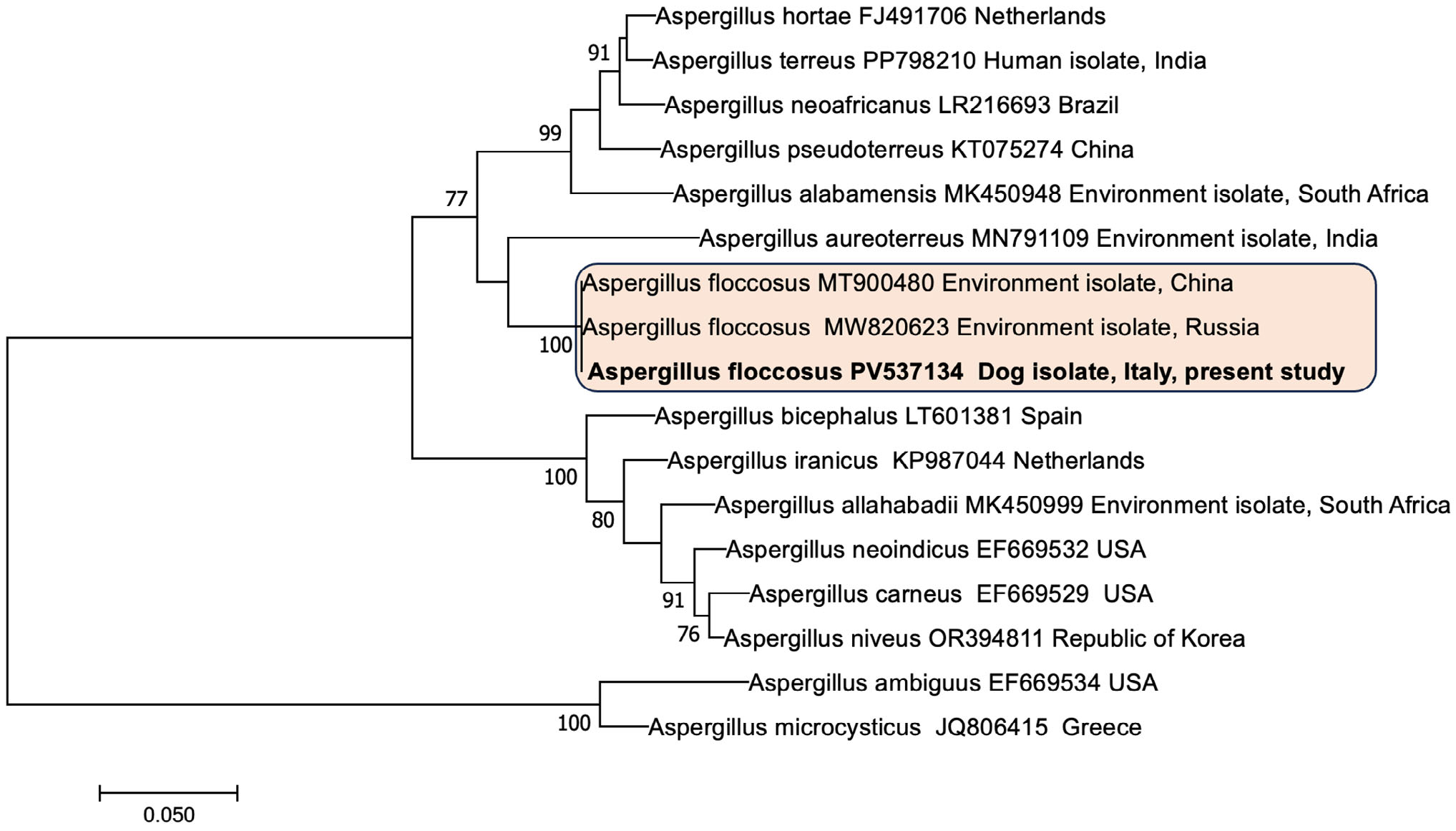
为了进行准确的物种鉴定,对β-微管蛋白基因进行了测序。与已发表数据相比,与丛毛状曲霉的相似度为100%,与土曲霉的相似度为99.81%。序列比对使用BioEdit 7.2.5软件进行,最大复合似然树通过MEGA 7软件获得(下图)。
03 治疗
在培养结果出来前,由于尿沉渣中存在真菌成分,选择氟康唑(5 mg/kg,每日两次)作为抗真菌治疗。
还进行了镇痛治疗,使用加巴喷丁(10 mg/kg,每日三次)以及曲马多(3 mg/kg,每日三次)。
04 预后
2周时,神经症状显著改善,疼痛缓解,后肢本体感觉性共济失调和左前肢跛行有所好转。C反应蛋白正常,尿液分析未见真菌菌丝。
3个月后,仍在接受氟康唑治疗,发现了血尿。尿液显示存在真菌菌丝,对氟康唑和伊曲康唑进行了抗真菌药物敏感性试验。结果显示,氟康唑和伊曲康唑的最小抑菌浓度值分别为大于256 mg/L和等于0.25 mg/L。随后改用伊曲康唑(5 mg/kg,每日两次)进行治疗。病情显著改善,后肢的本体感觉性共济失调和左前肢的跛行完全消失。
16个月后,因急性严重痉挛性下肢瘫痪,伴随最后胸椎水平的触痛就诊。怀疑存在T3-L3水平的脊髓病变。犬主2周前在无任何医学指征的情况下停用了抗真菌治疗。轻度中性粒细胞增多(白细胞17210/mm³ [5000–14000],中性粒细胞15060/mm³ [3000–10000]),C反应蛋白轻度升高至1.36 mg/dL [0–0.8]。尿沉渣中再次发现真菌菌丝。第二次胸腰椎MRI显示,疑似脓肿导致的右侧T11-T13椎体压迫性脊髓病变,伴随胸腰椎水平多个椎间盘及其终板的形态和信号强度显著改变(下图)。
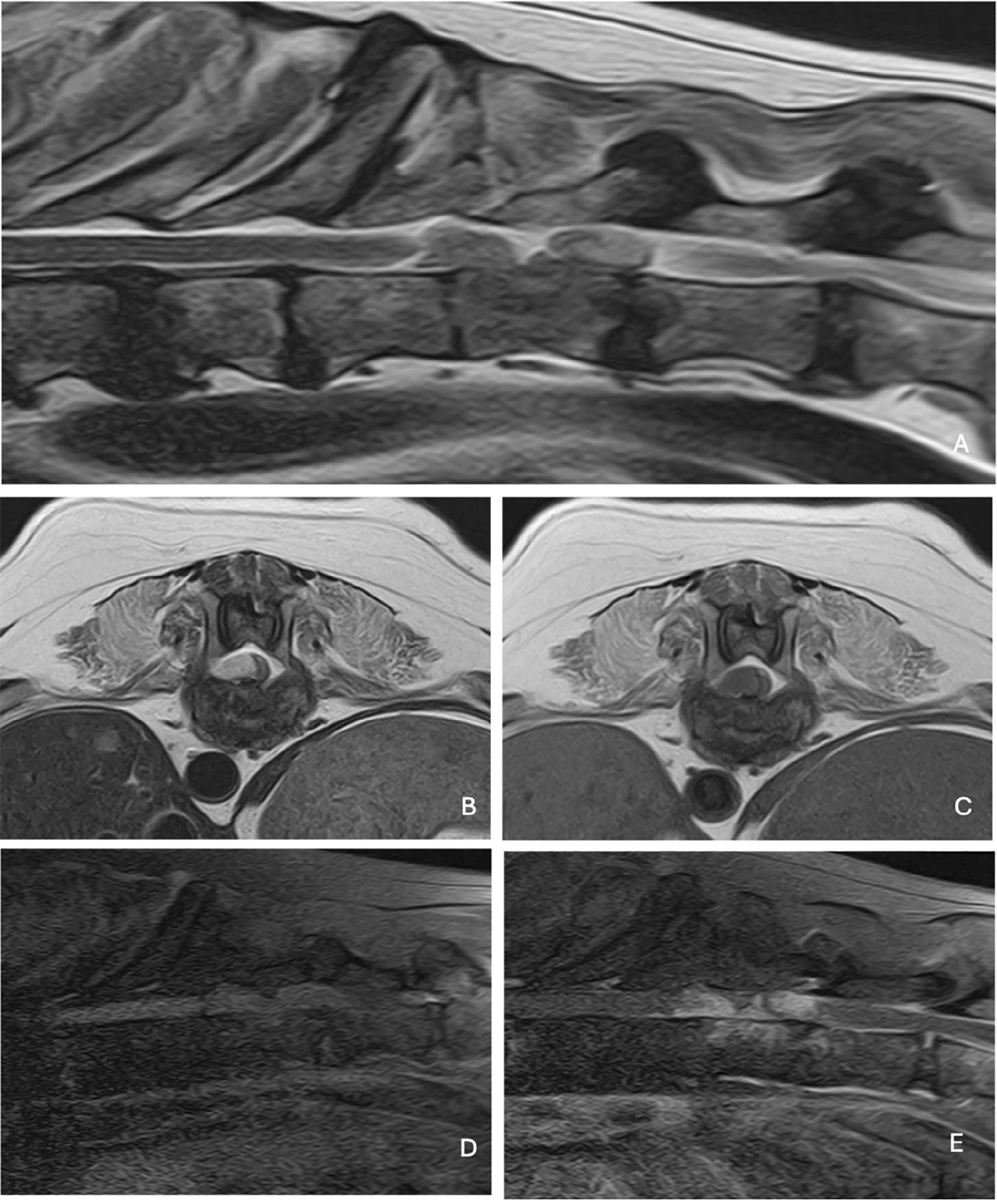
↑ (A)矢状位T2加权;(B)冠状位T2加权;(C)冠状位T1加权;(D)冠状位T1加权脂肪抑制;(E)冠状位T1加权脂肪抑制增强。相邻终板出现多发性不规则及溶骨性改变,正常椎间盘形态缺失。由于高摄取造影剂物质导致的T11-T13椎管外压迫性脊髓病变,与脊柱硬膜外脓肿一致。
由于神经系统状况迅速恶化导致截瘫,因此在随后48小时内实施了安乐死。
05 讨论
犬的播散性真菌感染可由多种病原体引起,包括透明菌丝真菌和色素菌丝真菌。其中,最常见的病原体为曲霉(Aspergillus)。犬全身性曲霉病是由曲霉属的真菌引起的严重感染性疾病,常导致致命结局。
德国牧羊犬是受影响最严重的犬种,这与该犬种遗传性黏膜免疫缺陷有关,尽管其他犬种也可能感染,尤其是免疫功能低下或合并其他疾病的犬。
曲霉菌的主要入侵途径通常为呼吸道,但伤口和骨骼创伤也是潜在风险因素。血源性传播可能导致多器官受累,特别是呼吸系统、消化系统、神经系统、肌肉骨骼系统、泌尿系统、淋巴系统和眼睛。
犬的临床表现高度多样化,无论是严重程度还是解剖分布,症状可能急性发作或呈慢性经过。早期阶段通常表现为发热、疲劳、体重减轻和淋巴结肿大等非特异性症状,随着疾病进展这些症状往往加重。
土曲霉(Aspergillus terreus)是犬全身性真菌病中最常报告的真菌种类,尽管偶尔也会报告杂色曲霉(Aspergillus versicolor)、阿拉巴马曲霉(Aspergillus alabamensis)和弯头曲霉(Aspergillus deflectus)。本研究描述了首例由丛毛状曲霉(Aspergillus floccosus)引起的犬曲霉病病例,并分离出一种非典型表型。
尽管血液检测是疑似椎间盘脊椎炎患者的初步筛查手段,且C反应蛋白似乎在诊断中具有实用价值,但诊断性影像学检查对于识别椎间盘感染至关重要。
X光检查是首选的诊断成像方法,因其非侵入性、成本低廉且在大多数兽医诊所均易于获取。然而,它可能无法在疾病早期阶段检测到病变。因此,需通过MRI或CT等高级诊断成像技术来确诊。
MRI是诊断椎间盘脊椎炎的金标准,相较于其他影像学模态具有显著优势。由于其高软组织分辨率,MRI能更清晰地显示椎间盘及周围组织的炎症,并检测脊柱脓肿的存在,为治疗规划提供关键信息。
除先进影像学发现外,实验室检测对确认真菌存在至关重要。本病例表明,尿液标本可提供信息且无创。其可快速提供初步数据,有助于明确诊断流程的下一步措施。病原体的分子学确认对制定适当治疗方案至关重要,尤其在形态学表现不典型的情况下。
丛毛状曲霉首次由Samson等人描述,仅从环境样本中分离得到。丛毛状曲霉属于Terrei组,这证实了犬全身性曲霉病常由该组中的物种引起。该真菌的不寻常形态使鉴定变得困难。
事实上,本病例在SAB-CAF和CZAPEK琼脂培养基上观察到的表现与Samson和Pangging等人对丛毛状曲霉的描述不符,后者报告了絮状质地和典型、密集柱状的分生孢子。在本病例的培养中,未观察到典型的曲霉菌分生孢子,仅发现厚壁孢子。形态差异的原因尚不明确,曲霉属真菌的形态学鉴定可能相当复杂,原因包括隐性种的存在以及缺乏特征性显微结构。
基于上述原因,强烈建议采用分子方法对曲霉属进行鉴定,即利用核糖体内部转录间隔区(ITS)进行属鉴定,并通过编码蛋白质的基因(如β-微管蛋白基因)进行精确的种属鉴定。
此类侵袭性感染的治疗管理,通常为终身性的,这是另一个关键问题。一个严重的问题是最新一代抗真菌药物(如伏立康唑和泊沙康唑)的高昂成本,限制了动物使用。
此外,即使采用针对性治疗,犬曲霉菌病的预后通常仍不乐观。患有全身性曲霉菌病的犬生存期差异显著,接受治疗的犬中位生存时间为226天。在某些病例中,生存时间已超过1000天,而停药后常观察到病情迅速恶化直至死亡,如本病例所示。
总之,这是首例由丛毛状曲霉引起的犬播散性曲霉病合并椎间盘炎的病例报告。尽管罕见,但对于出现神经症状且血常规或生化结果非特异性异常的犬,尤其是德国牧羊犬,应将曲霉菌病纳入鉴别诊断范围。分子学检测对于识别隐性曲霉菌种(尤其是当观察到非典型病变时)以及制定适当治疗方案至关重要。
文献来源:Bordoni T, Okonji S, Dini FM, Cricca M, Gandini G, Caffara M, Galuppi R. First Description of Atypical Aspergillus floccosus as Cause of Canine Systemic Aspergillosis With Discospondylitis. Vet Med Sci. 2025 Jul;11(4):e70466.