
| 一般情况 | |
 | 品种:短毛猫 |
| 年龄:2岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:胰腺癌 | |
01 主诉及病史
因腹部膨隆2个月和厌食4天就诊。
既往无疾病史或腹部手术史。
02 检查及治疗
体重5.3公斤。腹部严重膨隆,有波动感,体温轻度偏低(37.1°C)。血糖轻度升高(178 mg/dl [71–148]),血清淀粉样蛋白A水平升高(5.27 µg/ml [<3.75]),脂肪酶活性正常(23.9 U/l [<30])。
腹部X光显示腹腔透亮度增加和消化道影像重叠(下图)。
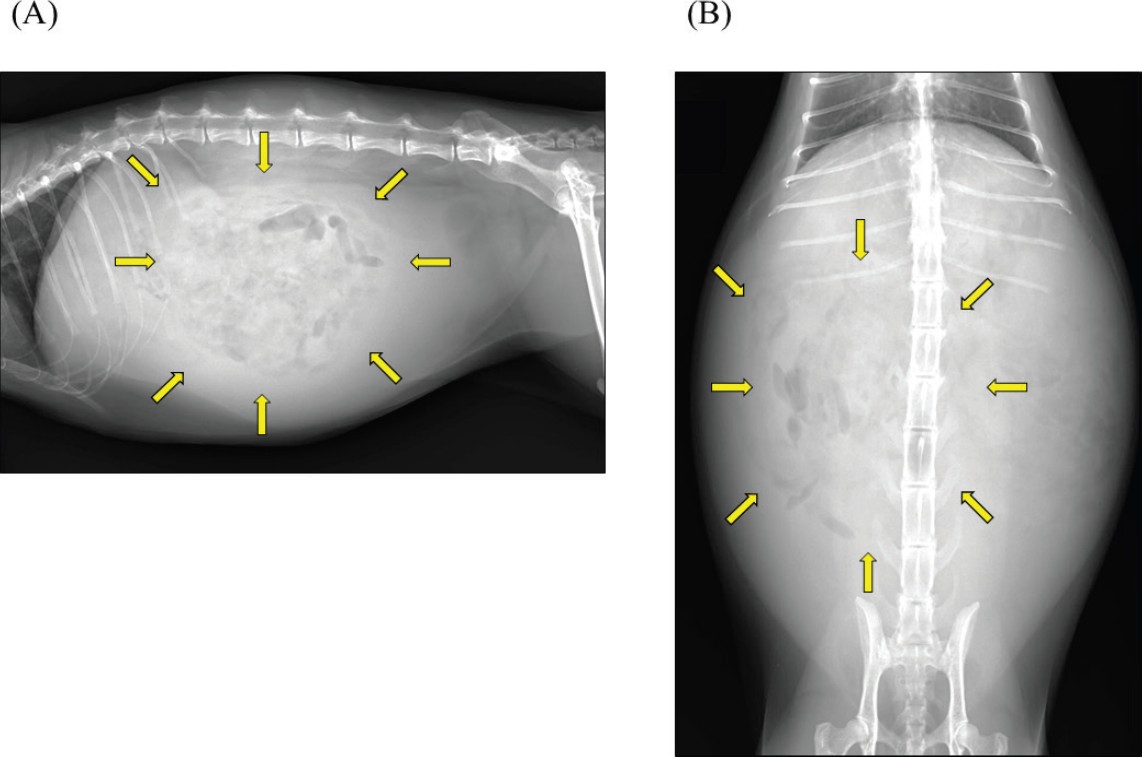
↑ (A)右侧位和(B)腹背位X光片。显示腹部严重膨隆,对比度普遍降低,提示腹水。观察到轻度气体滞留和肠道聚集(箭头)。
腹部超声发现严重腹水、小肠蠕动减弱、胰腺增大,腹膜不规则增厚并伴有多个结节(下图)。
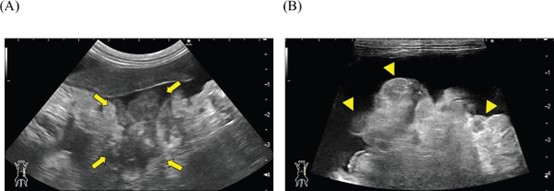
↑ 腹部超声。整个腹部观察到严重腹水。(A)左上腹部观察到一个低回声不规则区域(箭头),被认为是增大的胰腺。(B)腹膜表现出不规则增厚,内部有散在的低回声结节形成(三角)。心脏超声未发现异常。
腹水分析显示总核细胞计数为1000个/μl,未发现肿瘤细胞或细菌感染,上清液比重为1.024,确认腹水为渗出液(下图)。
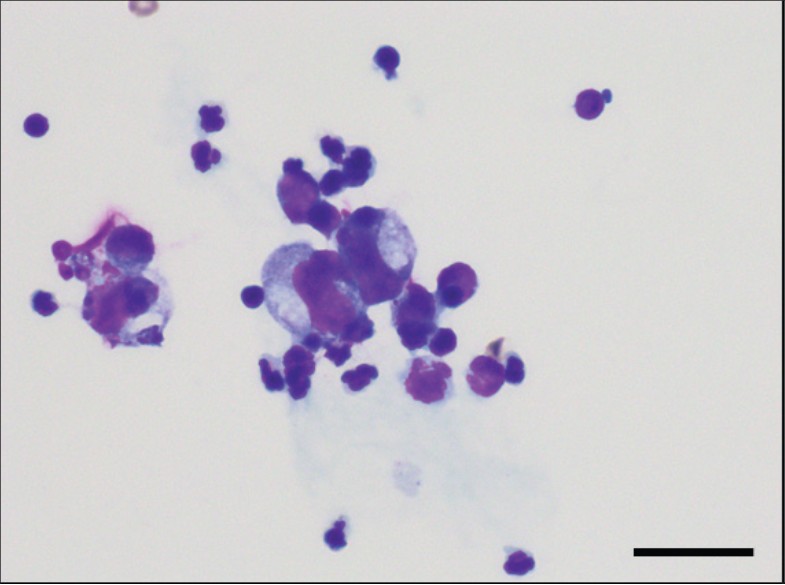
↑ 腹水沉渣细胞学检查。涂片显示细胞成分低,仅有少量轻度变性的中性粒细胞和巨噬细胞。未发现肿瘤细胞或细菌感染的证据。
由于腹水中未检测到猫冠状病毒基因,且血清中抗冠状病毒抗体滴度未升高,猫传染性腹膜炎被认为不太可能。根据影像学表现,如腹膜增厚、胃肠道影像重叠和严重腹水,初步怀疑为包裹性腹膜硬化。这些表现与包裹性腹膜硬化的典型表现一致,特征为腹膜纤维化增厚和腹腔器官包裹。由于猫的年龄较轻,恶性肿瘤的可能性被认为较小。
开始使用泼尼松龙(10 mg/只,q24h)和恩诺沙星(25 mg/只,q24h)进行试验性治疗,分别用于管理疑似炎症过程和潜在细菌感染。但未观察到临床改善,提示潜在疾病可能比最初怀疑的更为复杂。
初次就诊后的第12天,进行了非镇静CT。未使用麻醉,将患者固定在亚克力笼中(CT胶囊)。CT显示胰腺呈肿瘤样增大,腹膜背侧不规则散在结节聚集,右肺下叶呈磨玻璃样改变(下图)。由于未进行血管造影,无法评估血管特征和软组织肿块的更详细鉴别。
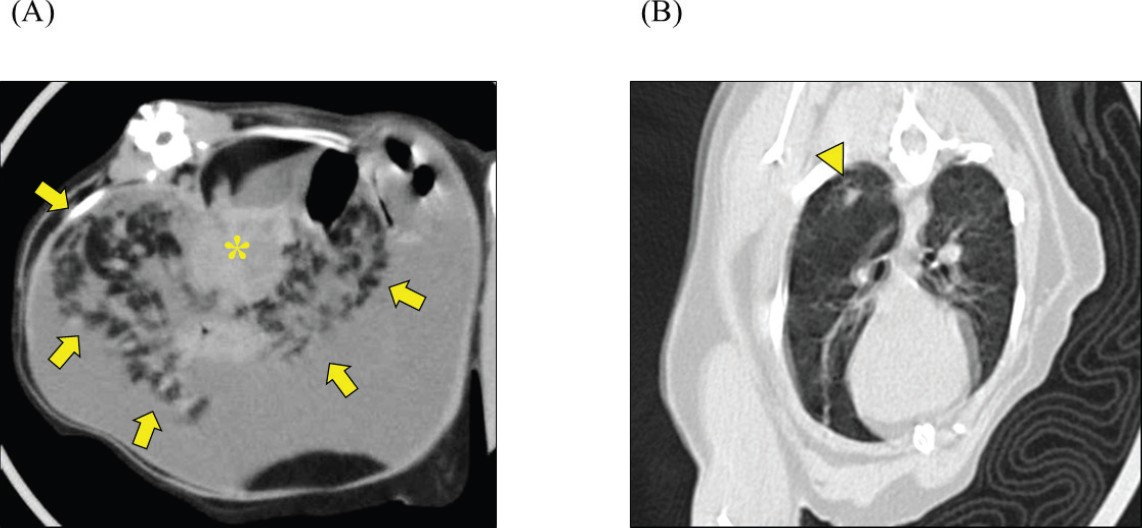
↑ CT扫描。显示了(A)上腹部和(B)胸部的横断面CT图像。肠系膜脂肪显示出以增大且呈肿瘤样胰腺(*)为中心的散在结节,且结节轮廓不规则(箭头)。右肺下叶观察到磨玻璃样改变(三角)。
怀疑胰腺肿瘤,但由于动物状况不佳,诊断性和治疗性外科干预被认为困难。主人拒绝进一步侵入性操作,如细针抽吸或腹腔镜检查。尽管进行了泼尼松龙治疗、腹水引流和液体疗法,猫在初次就诊后的第19天死亡。
03 尸检
在获得主人同意后,于死亡当天进行了尸检。肉眼观察显示,存在严重的腹水,且少量纤维素附着于腹腔器官的浆膜面(下图A)。大网膜、小网膜和肠系膜增厚且质地坚硬,伴有多个结节形成(下图B)。胰腺和上段小肠被这些腹膜组织覆盖,并在上腹部形成一个肿块,导致活动性丧失。腹壁和膈肌腹侧观察到大量不规则结节(下图C-D)。在全面检查中未发现腹腔淋巴结。
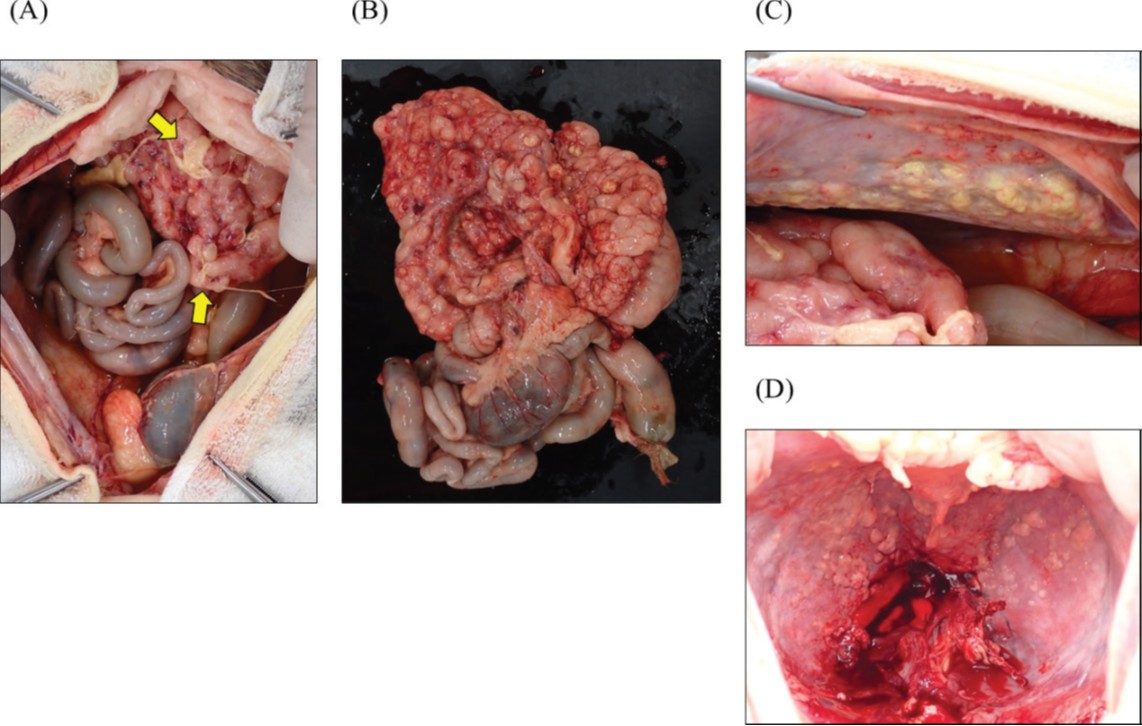
↑ 尸检的肉眼观察结果。(A)不规则增厚的腹膜(大网膜、小网膜和肠系膜)在上腹部形成了一个肿块。在腹腔器官的浆膜表面观察到少量纤维素沉积(箭头)。(B)上段小肠被不规则增厚的腹膜覆盖,导致活动性丧失。(C)左侧腹壁和(D)膈肌腹侧观察到多个白色至黄白色的结节,大小为3−5毫米。
组织病理学检查显示,胰腺出现肿瘤细胞的浸润性增殖,形成导管结构和片状增殖模式,肿瘤组织中心出现坏死和部分黏液分泌,提示为原发性胰腺肿瘤(下图A-B)。在大网膜、小网膜、肠系膜和腹膜壁中,观察到具有类似特征的肿瘤细胞浸润性增殖,少量炎症细胞存在以及显著的纤维化(下图C-D)。腹壁、膈肌、膀胱浆膜和肺部观察到转移性病变。肿瘤细胞对细胞角蛋白AE1/AE3、细胞角蛋白7和细胞角蛋白20呈阳性反应,对波形蛋白呈阴性反应,表明肿瘤组织分化为胰腺外分泌细胞,特别是胰腺导管上皮细胞(下图E–G)。尽管这些发现与外分泌性胰腺腺癌的诊断标准一致,但细胞角蛋白7和20的免疫阳性率约为20%或更低。肿瘤细胞对WT1抗体呈阴性反应,Grimelius染色亦呈阴性,排除了间皮瘤和神经内分泌肿瘤(下图H-I)。
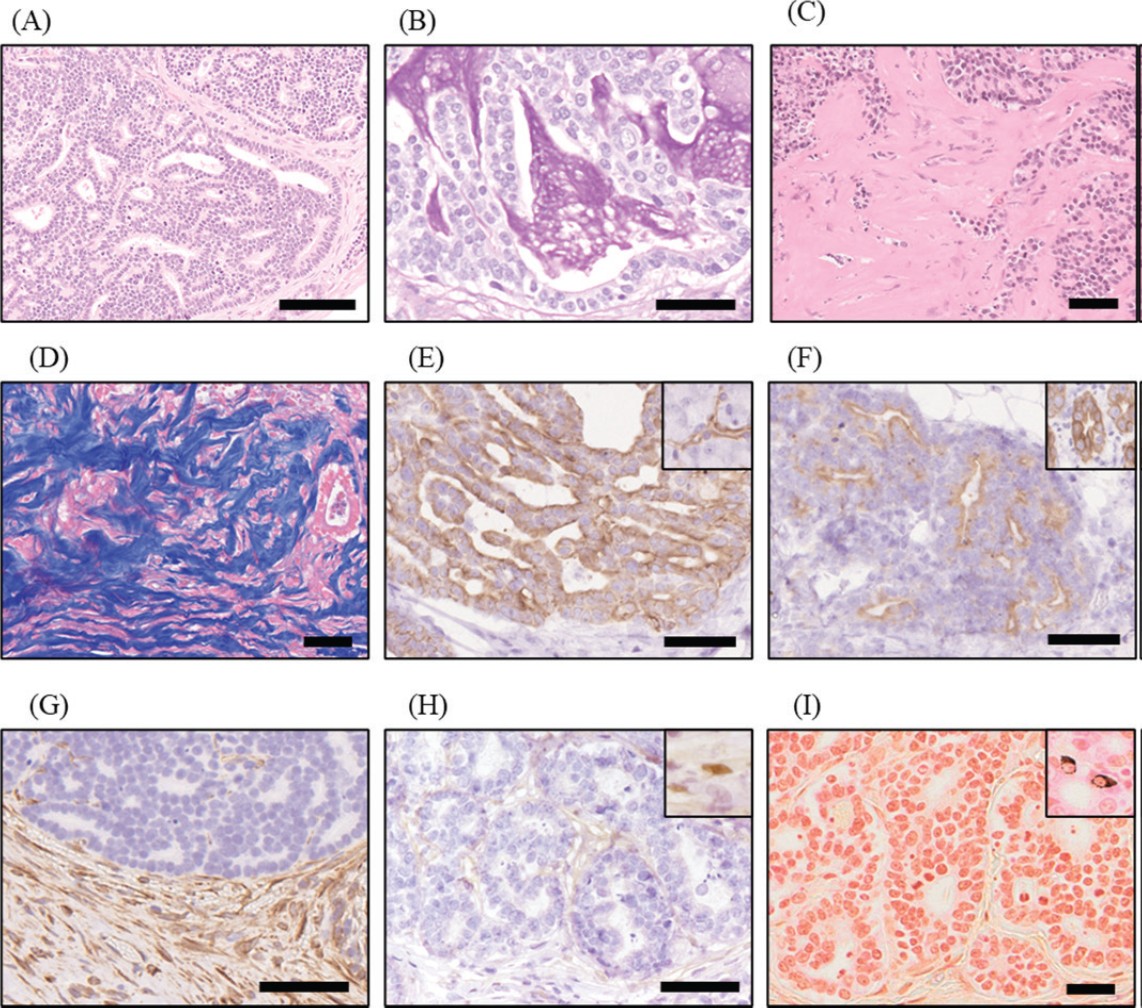
↑ 组织病理学发现。(A)肿瘤组织增殖,形成导管结构和片状模式。(B)肿瘤导管结构内腔中的黏液对过碘酸雪夫氏(PAS)反应呈阳性。(C)在腹膜肿瘤组织的基质中观察到严重的纤维化。(D)肿瘤组织基质中的纤维化区域通过Azan染色呈深蓝色。(E)肿瘤细胞对细胞角蛋白7呈阳性反应。该病例中胰腺的导管细胞(插图)对同一种抗体也呈阳性反应。(F)肿瘤细胞对细胞角蛋白20呈阳性反应。该病例中的肠上皮细胞(插图)对同一种抗体呈阳性反应。(G)肿瘤细胞对波形蛋白抗体呈阴性反应,而周围的基质细胞,包括成纤维细胞,呈阳性反应。(H)肿瘤细胞对WT1抗体呈阴性反应。该病例中的间皮细胞(插图)对同一种抗体呈阳性反应。(I)肿瘤细胞对Grimelius染色呈阴性反应。分布在肠上皮细胞中的神经内分泌细胞(插图)对Grimelius染色呈阳性反应。
最终被诊断为因外分泌性胰腺腺癌引起的癌性腹膜炎,疑似为胰腺导管腺癌(T1N0M1)。胰腺肿块以及类似包裹性腹膜硬化的硬化和增厚的腹膜导致胃肠道梗阻和严重腹水,原因是压迫了血管系统。
04 讨论
包裹性腹膜硬化(Encapsulating Peritoneal Sclerosis, EPS)是一种罕见但严重的腹膜疾病,其特征为腹膜弥漫性增厚、纤维化,并可包绕腹腔内脏器,导致肠梗阻、腹水及营养不良等临床表现。
在人类医学中,EPS多见于长期腹膜透析患者,也可继发于腹部手术、感染或异物反应。其发病机制尚不完全明确,可能与慢性炎症刺激、腹膜间皮细胞损伤及异常修复过程有关。组织学上表现为腹膜间皮层缺失、成纤维细胞增生及大量胶原纤维沉积。
在兽医领域,EPS的报道极为稀少,目前猫仅有5例报道,其中3例为特发性,2例继发于细菌性腹膜炎。由于病例数量有限,尚无统一的治疗方案,预后普遍较差。部分早期特发性病例在手术干预和免疫抑制治疗下可获得较长时间的缓解,而多数病例则在确诊后不久死亡或安乐死。
本病例最初因腹水、腹膜增厚及肠道聚集等影像学表现而被高度怀疑为EPS,但最终通过尸检确诊为胰腺外分泌腺癌伴腹膜广泛转移。该结果提示,胰腺肿瘤引起的癌性腹膜炎在临床表现和影像学特征上可高度模拟EPS,极易造成误诊。
本例患猫年仅2岁,属于胰腺腺癌发病年龄显著偏低的个体。猫胰腺外分泌腺癌通常发生于10岁以上老龄猫,具有高度侵袭性和转移倾向,常见转移部位包括腹膜、肝脏和肺。本病例中,胰腺原发肿瘤虽未形成巨大肿块,但已导致广泛的腹膜种植性转移,并形成大量纤维组织,造成肠道包裹和梗阻,临床上表现为顽固性腹水和肠蠕动减弱,极似EPS。
影像学检查(超声和CT)虽提示胰腺增大和腹膜结节,但由于患猫年龄较轻,初诊时未优先考虑恶性肿瘤,导致未能及时进行更具侵入性的诊断手段(如穿刺活检或腹腔镜探查)。
此外,腹水细胞学检查未发现肿瘤细胞,也未能提供明确线索。最终诊断依赖于尸检和组织病理学检查,结合免疫组化染色(CK7、CK20、AE1/AE3阳性,vimentin、WT-1阴性)确诊为胰腺导管腺癌。
该病例也提示我们,胰腺肿瘤在猫中虽罕见,但其腹膜转移可诱发显著的纤维组织反应,形成所谓的“癌性硬化性腹膜炎”,在影像和肉眼观察上与EPS几乎难以区分。类似病例在猫和犬中已有零星报道,但本例为目前报道中最年轻的一例,具有重要的临床警示意义。
总之,本病例强调了在年轻猫中亦需警惕恶性肿瘤的可能性,尤其是当影像学表现提示EPS样病变时,不能仅凭年龄排除肿瘤性疾病。胰腺腺癌虽罕见,但其腹膜转移可模拟EPS,造成误诊和延误治疗。对于表现为顽固性腹水、腹膜增厚及肠梗阻的病例,应尽早考虑进行更具侵入性的检查,如腹水肿瘤标志物检测、穿刺细胞学、腹腔镜或开腹探查,以提高生前诊断率。
此外,本病例也反映出目前兽医领域对EPS及类似病变的认知仍有限,特别是在鉴别诊断和治疗策略方面亟需更多研究和病例积累。未来应加强对猫胰腺肿瘤及其腹膜表现的研究,明确其病理机制与纤维化过程的关系,从而提升早期识别和干预能力,改善患猫的预后。
文献来源:Kobayashi K, Kawabata Y, Kadekaru S, Sakai O, Yoshitake R, Mochizuki Y, Nakamura SI, Kutara K. Postmortem diagnosis of exocrine pancreatic adenocarcinoma mimicking encapsulating peritoneal sclerosis in a cat: Clinical and histopathological insights. Open Vet J. 2025;15(8):3904-3911.